CAPA SOFTWARE
Optimieren Sie Ihr digitales CAPA Management
Maximieren Sie die Effizienz Ihrer Korrektur- und Vorbeugemaßnahmen (CAPA) durch automatisierte, digitale Workflows. Gewährleisten Sie die Qualität Ihrer Produkte und Dienstleistungen, während Sie gleichzeitig interne und gesetzliche Vorgaben berücksichtigen.
Berücksichtigung von internen und gesetzlichen Vorgaben
Automatisierte Weiterleitung und Eskalationsmanagement
Echtzeit-Übersicht über alle Korrektur- & Vorbeugemaßnahmen

Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr Informationen» dls | capa «
Wie unterstützt ein CAPA Prozess bei QM-Prozessen?
Software für Ihre CAPA Prozesse
Steuern Sie Ihre produktionsbegleitenden Qualitätsmanagement-Prozesse, einschließlich Korrektur- und Vorbeugungsmaßnahmen (CAPA), mit unseren fortschrittlichen digitalen Workflows. Unsere integrierten Lösungen transformieren Ihren bisherigen papiergebundenen Prozess vollständig in einen digitalen Workflow – von der Erfassung bis zum Abschluss.
Dank unseres effizienten Workflowsystems wird das digitale CAPA-Formular automatisch an die nächste Instanz weitergeleitet. Bei Zeitüberschreitungen greift das Erinnerungs- und Eskalationsmanagement proaktiv, um Verzögerungen zu vermeiden. Darüber hinaus gewährleistet eine integrierte Regelung für das Aufgabenrouting die Vertretungsberechtigung, sodass auch im Falle von Abwesenheiten die Kontinuität der Prozesse sichergestellt ist.
Welche Vorteile bietet eine CAPA Software?
Welche Vorzüge bietet Ihnen die CAPA Software?
Prozesssicherheit
Das Workflowsystem stellt sicher, dass der CAPA nach jedem Schritt an den jeweils fachverantwortlichen Adressaten weitergeleitet wird. Bei Zeitüberschreitungen greift das Eskalationssystem.
Datenintegrität
Alle Korrektur- und Vorbeugemaßnahmen (CAPAs) werden digital erfasst, wodurch der Verlust relevanter Informationen ausgeschlossen wird. Ihre Daten sind zudem vor unbefugtem Zugriff sowie vor möglichen Beschädigungen geschützt.
Stetige Verfügbarkeit
Greifen Sie jederzeit und von jedem Ort auf Ihre Daten zu – unabhängig von Ihrem Standort.
Zentrale Informationsplattform
Nutzen Sie d.velop documents (ehemals d.3ecm) als zentrale Informationsquelle, um Ihre Daten effizient abzurufen.
Nachverfolgbarkeit
Verknüpfen Sie CAPAs mit Modulen wie der Änderungskontrolle (Change Control) für eine lückenlose Dokumentation sämtlicher Einzelprozesse. CAPA’s können z.B. aus Abweichungsmeldungen initiiert werden oder einen Änderungsprozess initiieren.
Transparenz
Jeder berechtigte Mitarbeiter hat Zugriff auf den aktuellen Status aller CAPA-Prozesse, unabhängig von seiner Rolle im Prozess.
Individuelle Konfiguration
Passen Sie die Module an Ihre spezifischen Anforderungen an, um den Einarbeitungsprozess Ihrer Kollegen zu erleichtern.
Reports
Erstellen Sie umfassende Reports und Statistiken über Ihre CAPAs für fundierte Entscheidungen.
Wie arbeite ich mit einer CAPA Software?
Erhalten Sie einen ersten Überblick
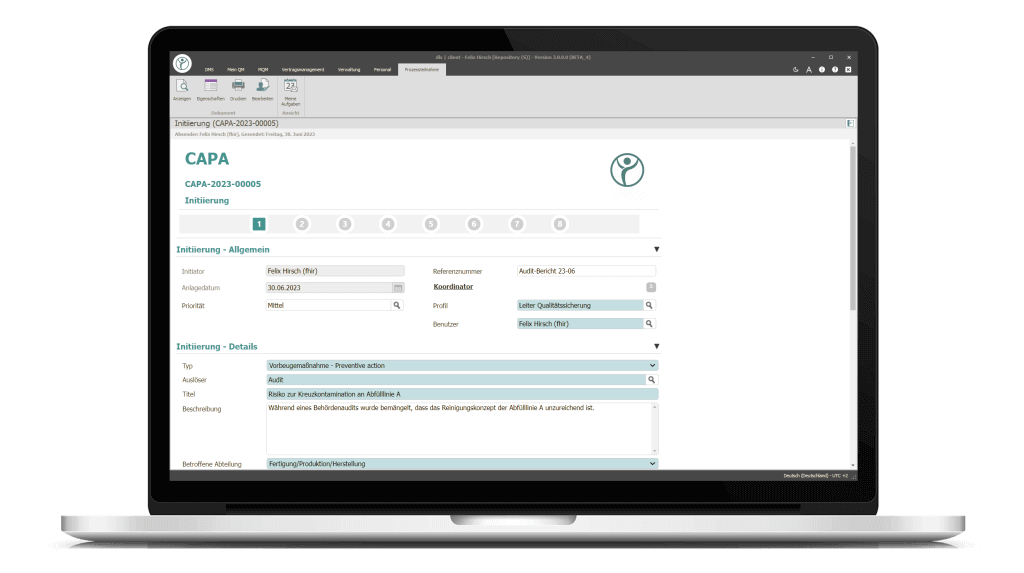
Die digitalen Formulare werden parallel auch in ein PDF/A umgewandelt. So können auch nicht prozessbeteiligte MitarbeiterInnen Einblick in den Workflow erhalten und das Dokument bei Bedarf mit Externen geteilt werden.
Was ist ein CAPA-Prozess?
Der CAPA-Prozess (Corrective and Preventive Action) erlaubt es, Fehler/Abweichungen im Rahmen der Arzneimittelsicherheit systematisch zu erfassen und in Übereinstimmung mit den regulatorischen und internen Vorgaben zu bearbeiten. Dabei stehen die Beseitigung von Nichtkonformitäten (Korrekturmaßnahmen) sowie die Vermeidung von möglichen Nichtkonformitäten (Vorbeugemaßnahme) im Fokus des CAPA-Managements.
Nichtkonformitäten resultieren beispielsweise aus einer Prozessabweichung welche bestimmte Korrekturmaßnahmen zur Folge hat, durch welche das bestehende Problem beseitigt werden kann.
Eine Vorbeugemaßnahme könnte zum Beispiel aus einer OOT-Analyse resultieren. Hier ist es noch zu keiner tatsächlichen Nonkonformität gekommen, aber es wurde eine Verschlechterung des validierten Prozesses festgestellt.
Durch den CAPA-Prozess kann somit eine kontinuierliche Produktqualität gewährleistet werden.
Jede Aktion im Prozess wird entsprechend automatisch vom System dokumentiert. Integrierte Audit-Trail-Funktionen gewährleisten die hohe Nachvollziehbarkeit.
Das digitale Formular wird Schritt für Schritt ausgefüllt und mit den relevanten Eintragungen und Daten versehen. Blau hinterlegte Felder kennzeichnen Eingabe-Pflichtfelder. Vordefinierte Wertemengen und Drop-Down-Funktionen erleichtern den Anwendern das Ausfüllen des Formulars.
Durch das Workflowsystem werden nach Bearbeitung der einzelnen zu durchlaufenden Schritte (1. Initiierung, 2. Maßnahmen- und Risikoerfassung, 3. Fachgremium, usw.) automatisch Aufgaben und Nachrichten an zuständige Bearbeiter bzw. Workflowteilnehmer versandt. Nach Bearbeitung sämtlicher Schritte gilt der Prozess als abgeschlossen.
1. Schritt: Initiierung
Die Initiierung der CAPA erfolgt durch den Prozessverantwortlichen der betroffenen Abteilung. Er erfasst die relevanten Daten zur CAPA. Im Anschluss wird der Prozess an den definierten CAPA-Verantwortlichen weitergeleitet.
Wie sieht eine CAPA Software live aus?
Wünschen Sie einen Live-Einblick zur CAPA Software?
Erhalten Sie innerhalb von nur 45 Minuten einen umfassenden Live-Einblick in die Möglichkeiten der produktionsbegleitenden Qualitätsmanagementprozesse anhand eines konkreten Anwendungsfalls. Lernen Sie, wie Sie mit den Lösungen von Digital Life Sciences Ihre produktionsbegleitenden QM-Prozesse, wie beispielsweise Reklamationen (Complaint Management), Abweichungsmeldungen (Deviation Control), Korrektur- und Vorbeugemaßnahmen (CAPA) sowie Änderungskontrollen (Change Control), effizient durch unsere digitalen Workflows steuern können.
Welche Funktionen hat eine Korrektur- und Vorbeugemaßnahmen Software?
Features der Korrektur- und Vorbeugemaßnahmen Software
- Automatische Klassifizierung der Abweichungen basierend auf eingegebenen Metadaten
- Referenzieren der Stammdaten aus Ihrem ERP-System
- Integrierte Vertreterregelung für begrenzte Erreichbarkeit
- Initiierung der Einzelaufgaben für die weitere Bearbeitung des Prozesses
- Ergänzung von Dokumenten, wie z.B. Digitalfotos zu Ihrem CAPA-Formular
- Initiierung eines Dokumentenänderungsantrages für ein gelenktes Dokument
- Eskalationsmeldungen sowohl innerhalb des Systems als auch per E-Mail
- Automatische PDF-Erstellung und Ablage des Formulars im eDMS nach jedem Schritt
Welche regulatorischen Anforderungen muss ein CAPA Prozess erfüllen?
Regulatorische Anforderungen beim CAPA Prozess
33 Gute Gründe für eine Zusammenarbeit mit Digital LS
Sie sind noch nicht überzeugt? Erfahren Sie 33 Gute Gründe, die für eine Zusammenarbeit mit der Digital Life Sciences GmbH sprechen. Dabei zeigen wir Ihnen sowohl Gründe aus Anbietersicht, aus Softwaresicht sowie weitere allgemeine Gründe, die uns auszeichnen.
Welche Unternehmen setzen ein CAPA Management ein?
Kundenmeinung zum CAPA Management
“Mit den Projektmitarbeitern der Firma Digital Life Sciences war eine rasche Implementierung des neuen DMS in nur drei Monaten möglich. Der modulare Aufbau des Systems erlaubt zusätzlich eine koordinierte schrittweise Erweiterung des Umfangs. Die Software wurde durch die übersichtliche Gestaltung schnell von allen Mitarbeitern angenommen, wodurch die Prozesse und Freigabezyklen in kürzester Zeit nicht nur vereinfacht, sondern auch qualitativ verbessert werden konnten."

Welche Software kann mit einem CAPA Management gemeinsam eingesetzt werden?
Das könnte Ihnen auch gefallen ...
Das CAPA Management ist ein Baustein der Digital Life Sciences Lösungssuite. Jedes Produkt für sich ist schon leistungsstark, gemeinsam eingesetzt sind sie sogar noch besser.

Dokumentenlenkung Software
Ob Arbeits- / Verfahrensanweisung (SOP’s), Prozessbeschreibungen, Prüfvorschriften oder andere Dokumenttypen — alle erstellen, revisionieren und unterschreiben Sie digital mit der Software Dokumentenlenkung.

Schulungsmanagement Software
Erweitern Sie das Modul “Dokumentenlenkung” um die aktive Planung und Protokollierung der Qualifikationen Ihrer Mitarbeiter mit unserer Schulungsmanagement Software.

E‑Learning Software
Nutzen Sie die neue Software “E‑Learning” um Ihre Mitarbeiter digital zu schulen. Erstellen Sie dazu ein E‑Learning frei nach Ihren Wünschen über Microsoft PowerPoint oder binden Sie bereits vorhandene Präsentationen ein.
CAPA (Korrektur- und Vorbeugemaßnahmen) FAQ
Häufig gestellte Fragen (FAQ's) zum CAPA
- Können die verwendeten Bezeichnungen geändert werden?
In der Workflow-Administration können Sie die Bezeichnung der Prozessschritte, Feldbezeichnungen und Wertemengen konfigurieren.
- Lassen sich die vorgegebenen Schritte verändern?
Der Prozessablauf des CAPA ist nach den Vorgaben der GxP-Regularien aufgebaut und in Abstimmung mit QM-Fachleuten erstellt worden. Vor dem Hintergrund der Validierungsdokumentation sind die Prozessschritte daher obligatorisch. Jeder Prozessschritt enthält jedoch einen ‚Custom Panel‘, über den weitere Informationen angezeigt oder Aktionen veranlasst werden können.
- Sind die Inhalte aller Prozessschritte sichtbar?
Bei der Bearbeitung eines Prozessschritts kann nur dieser bearbeitet werden, die anderen Prozessschritte sind jedoch sichtbar.
- Sind für die Bearbeitung der Prozessschritte zeitliche Vorgaben hinterlegt?
In der Administration lassen sich für jeden Prozessschritt zeitliche Vorgaben eingeben. Vor der Fälligkeit der Prozessschritte werden Erinnerungsmeldungen verschickt. Die Erinnerungsmeldung wird an den Bearbeiter der Aufgabe, den Koordinator sowie an die konfigurierte Gruppe, die über die Erinnerung informiert werden soll (z.B. QS), verschickt. Eine Erinnerung wird mit dem konfigurierten Betreff versendet.
- Sind Auswertungen der CAPAs möglich?
Die wesentlichen Daten eines CAPAs werden in die Attribute des Datensatz übernommen. Hierüber können Sie suchen und Auswertungen über die angelegten CAPAs erstellen. Die Auswertungen exportieren Sie optional als PDF, EXCEL oder WORD-Dokument.
- Gibt es Templates für Maßnahmen in einem CAPA?
Nach der Erfassung einer Maßnahme kann diese als Template in die Maßnahmentabelle gesichert werden. Die Templates stehen zum Einfügen in einem CAPA zur Verfügung. Der Termin für die Maßnahme wird auf Basis der im Template eingegebenen Dauer errechnet.
- Lassen sich Aufgaben delegieren?
In allen auf die Initiierung folgenden Prozessschritten können Sie den Prozessschritt an eine andere Person weiterleiten. Die Berechtigung des Empfängers wird bei der Auswahl überprüft.
- Lassen sich Prozessschritte nachträglich korrigieren?
Grundsätzlich wird ein Prozessschritt mit elektronischer Signatur abgeschlossen und ist nicht mehr zu korrigieren. Über die Funktion ‚Schritt zurück‘ kann der Prozess in einen vorhergehenden Prozessschritt zurückgeleitet werden. Der Benutzer, der diesen Schritt abgeschlossen hat, erhält ihn erneut zur Bearbeitung und der Prozess setzt sich ab diesem Schritt fort. Jedes Zurückleiten in einen vorhergehenden Schritt wird im Audit Trail erfasst.
- Kann ein Prozess abgebrochen werden?
Es kann konfiguriert werden, dass der Prozess in jedem Prozessschritt abgebrochen werden kann. Für den Abbruch ist die Angabe einer Begründung in einem Pflichtfeld zwingend erforderlich. Der Abbruch ist nur durch den Koordinator des Prozesses möglich.
- Können zu einem CAPA Anlagen abgelegt werden?
Werden zu einem Prozess noch weitere Dateien benötigt, können in allen Prozessschritten Anlagen hochgeladen und mit dem aktuellen Prozess verknüpft werden. Die Anlagen werden unter einer entsprechenden Dokumentart im DMS abgelegt und sind im CAPA unter ‚Anlagen‘ für alle Prozessbeteiligten einsehbar. Sie können konfigurieren, welche Dateitypen als Anlage gespeichert werden können und wie groß die Dateien sein dürfen.
- Was ist CAPA und warum ist es wichtig im Qualitätsmanagement?
CAPA steht für Corrective and Preventive Actions, also Korrektur- und Vorbeugemaßnahmen. Dieser Prozess ist ein zentraler Bestandteil des Qualitätsmanagementsystems (QMS) und dient der Identifizierung und Behebung von Problemen sowie der Prävention zukünftiger Vorfälle.
Korrekturmaßnahmen (Corrective Actions) zielen darauf ab, bestehende Probleme oder Abweichungen zu analysieren und dauerhafte Lösungen zu implementieren, um deren Wiederauftreten zu verhindern. Vorbeugemaßnahmen (Preventive Actions) hingegen beschäftigen sich mit der Identifikation potenzieller Probleme und der Einführung von Maßnahmen, um deren Auftreten von vornherein zu verhindern.
Die Bedeutung von CAPA liegt in seiner Fähigkeit, die kontinuierliche Verbesserung der Prozesse und Produkte eines Unternehmens zu fördern. Durch die systematische Erfassung, Analyse und Behebung von Fehlern sowie die Vorsorge gegen potenzielle Risiken trägt CAPA maßgeblich zur Erhöhung der Produktqualität, zur Einhaltung regulatorischer Anforderungen und zur Steigerung der Kundenzufriedenheit bei.
- Wie wird der CAPA-Prozess in der Praxis umgesetzt?
Die Umsetzung des CAPA-Prozesses folgt in der Regel mehreren standardisierten Schritten, die eine systematische und effektive Bearbeitung von Korrektur- und Vorbeugemaßnahmen sicherstellen:
- Problemidentifizierung
Abweichungen: Identifikation von Problemen wie Produktionsfehlern, Reklamationen oder internen Auditergebnissen, die auf eine Abweichung von den festgelegten Prozessen hinweisen.
Nichtkonformitäten: Feststellung von Diskrepanzen im Hinblick auf regulatorische Anforderungen, wie beispielsweise den EU-GMP-Richtlinien, sowie interne Qualitätsstandards. - Ursachenanalyse
Untersuchung: Systematische Analyse zur Ermittlung der Grundursache des Problems.
Datenanalyse: Analyse von Prozess- und Produktionsdaten zur Erkennung von Mustern, die zur Identifizierung der Ursachen beitragen. - Korrekturmaßnahmen (Corrective Actions)
Maßnahmenentwicklung: Auf Basis der Ursachenanalyse werden konkret umsetzbare Schritte zur Behebung der Probleme entwickelt. Dies kann Anpassungen an Arbeitsanweisungen, technischen Spezifikationen oder Produktionsprozessen umfassen.
Implementierung: Die entwickelten Maßnahmen werden in die betroffenen Prozesse integriert. Gegebenenfalls sind Anpassungen in der Software oder im Produktionslayout erforderlich. - Vorbeugemaßnahmen (Preventive Actions)
Risikobewertung: Nach der Behebung des Problems wird eine gründliche Bewertung vorgenommen, um festzustellen, ob ähnliche Probleme in anderen Bereichen oder Prozessen auftreten könnten.
Maßnahmen zur Vermeidung: Es werden Vorbeugemaßnahmen implementiert, um Wiederholungen des Problems zu verhindern. Dazu gehören Schulungen für das Personal, Verbesserungen in der Prozessüberwachung und Anpassungen im Bereich der Qualitätskontrolle. - Wirksamkeitsprüfung
Verifizierung: Nach Umsetzung der Korrektur- und Vorbeugemaßnahmen erfolgt eine Überprüfung, um sicherzustellen, dass die Maßnahmen effektiv sind und das Problem nachhaltig gelöst wurde.
Langfristige Überwachung: Eine kontinuierliche Überwachung der Prozesse und Ergebnisse gewährleistet, dass die Vorbeugemaßnahmen erfolgreich sind und keine erneuten Abweichungen auftreten. - Dokumentation und Berichterstattung
Protokollierung: Alle Schritte des CAPA-Prozesses – von der Problemerkennung bis zur Wirksamkeitsprüfung – werden umfassend dokumentiert. Dies ist essenziell für den Nachweis der Einhaltung regulatorischer Anforderungen.
Audit Trail: In einem digitalen CAPA-System wird ein lückenloser Audit Trail bereitgestellt, wodurch nachgewiesen wird, dass jede Maßnahme ordnungsgemäß durchgeführt und dokumentiert wurde. - Kontinuierliche Verbesserung
Der CAPA-Prozess ist zyklisch angelegt und fördert die kontinuierliche Verbesserung des Qualitätsmanagementsystems (QMS). Die gewonnenen Erkenntnisse fließen in die strategische Planung sowie in die Prozessoptimierung ein.
Durch diesen systematischen Ansatz gewährleistet der CAPA-Prozess, dass Probleme nicht nur kurzfristig behoben, sondern auch künftige Risiken minimiert werden, was letztendlich zu einer nachhaltigen Qualitätsverbesserung führt.
Schnellkontakt
Sie haben eine Frage zum Modul CAPA?
Unser Vertriebsteam hilft Ihnen zeitnah und gerne weiter.
