Definition des Begriffs („Was ist der EU-GMP Leitfaden?“)
Der EU-GMP Leitfaden, oder auch der “EU-Good Manufacturing Practice” Leitfaden, ist ein umfassendes Regelwerk, das von der Europäischen Union entwickelt wurde, um die Herstellung von Arzneimitteln und Wirkstoffen zu regulieren. Er legt die Standards für die Herstellung, Prüfung und Qualitätssicherung von Arzneimitteln fest. Der Hauptzweck dieses Leitfadens besteht darin, die Patientensicherheit zu gewährleisten, indem er sicherstellt, dass die hergestellten Arzneimittel von höchster Qualität sind und den vorgeschriebenen Standards entsprechen.
Warum ist der EU-GMP Leitfaden wichtig?
- Internationale Anerkennung: Der EU-GMP Leitfaden wird weltweit als Goldstandard für die Arzneimittelherstellung angesehen. Unternehmen, die nach diesen Richtlinien arbeiten, erhalten internationale Anerkennung und können ihre Produkte auf globalen Märkten vertreiben.
- Vertrauen der Verbraucher: Die Einhaltung dieser Standards erhöht das Vertrauen der Verbraucher in die Qualität der pharmazeutischen Produkte. Patienten verlassen sich darauf, dass ihre Medikamente sicher und wirksam sind.
Schlüsselaspekte des EU-GMP Leitfadens
- Anlagen und Ausrüstung: Der Leitfaden legt detaillierte Anforderungen an die Herstellungsanlagen und die verwendete Ausrüstung fest, um sicherzustellen, dass die Umgebung für die Arzneimittelherstellung geeignet ist.
- Qualitätskontrolle: Ein wesentlicher Teil des Leitfadens betrifft die Qualitätskontrolle, einschließlich der Probenahme, Prüfung und Freigabe von Arzneimitteln.
- Dokumentation: Die ordnungsgemäße Dokumentation ist entscheidend. Der Leitfaden fordert genaue Aufzeichnungen über den Herstellungsprozess und die Qualitätsprüfungen.
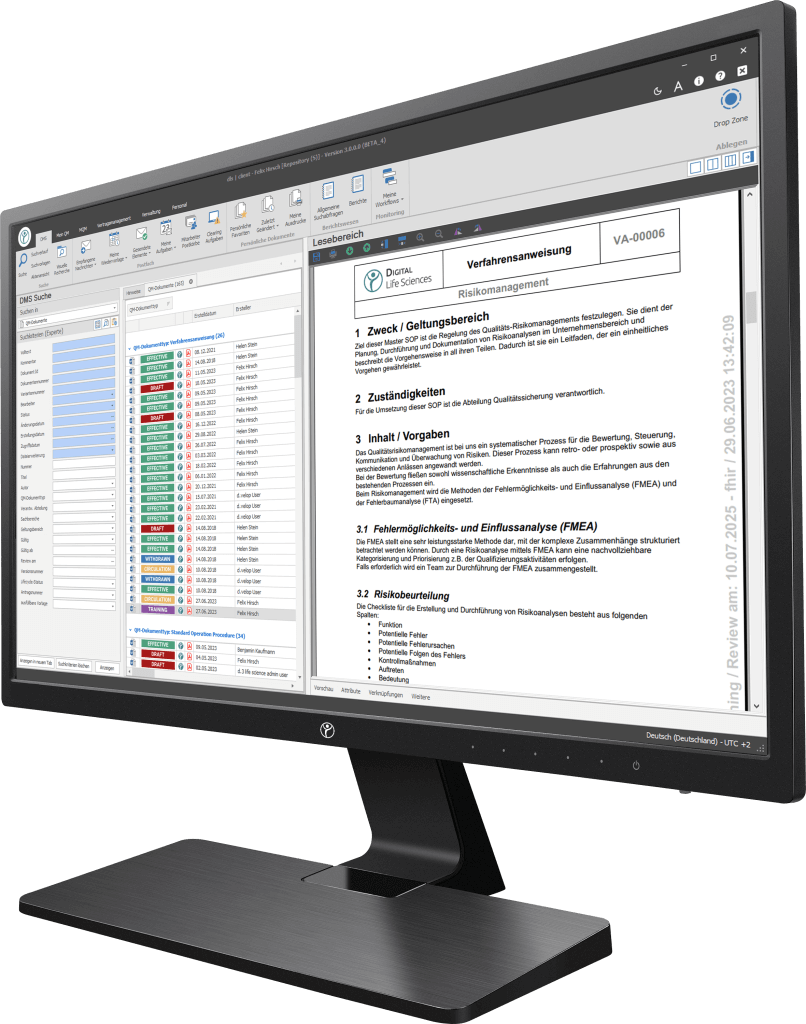
Ihr Weg in die Digitalisierung - Entdecken Sie unsere Software
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
Wer ist vom EU-GMP Leitfaden betroffen?
Der EU-GMP Leitfaden gilt für alle Unternehmen, die in der Herstellung von Arzneimitteln und Wirkstoffen tätig sind, unabhängig von ihrer Größe.
Herausforderungen bei der Einhaltung des EU-GMP Leitfaden
- Kosten: Die Implementierung der Richtlinien kann kostspielig sein, da Unternehmen möglicherweise ihre Anlagen aufrüsten und Schulungen für Mitarbeiter durchführen müssen.
- Komplexität: Die Einhaltung des Leitfadens erfordert ein tiefes Verständnis der pharmazeutischen Prozesse und der regulatorischen Anforderungen, was oft eine Herausforderung darstellt.
Fazit
Der EU-GMP Leitfaden ist ein unverzichtbares Werkzeug für Unternehmen in der Pharmaindustrie. Die Einhaltung dieser Richtlinien gewährleistet nicht nur die Qualität der hergestellten Arzneimittel, sondern trägt auch zur internationalen Anerkennung und zum Vertrauen der Verbraucher bei.
Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Was bedeutet EU-GMP?
EU-GMP steht für “European Union Good Manufacturing Practice” und sind die Qualitätsrichtlinien für die Arzneimittelherstellung in der Europäischen Union.
Welche Unternehmen müssen den EU-GMP Leitfaden befolgen?
Alle Unternehmen, die Arzneimittel oder Wirkstoffe in der EU herstellen oder in die EU exportieren, müssen den EU-GMP Leitfaden befolgen.
Wie können Unternehmen sicherstellen, dass sie den Leitfaden einhalten?
Unternehmen können externe Berater und Schulungen nutzen, um sicherzustellen, dass sie den EU-GMP Leitfaden ordnungsgemäß umsetzen.
Welche Vorteile bietet die Einhaltung des EU-GMP Leitfadens?
Die Einhaltung des Leitfadens verbessert die Qualität der hergestellten Arzneimittel, ermöglicht den Marktzugang und erhöht das Vertrauen der Verbraucher.
Gibt es internationale Äquivalente zum EU-GMP Leitfaden?
Ja, viele Länder haben ähnliche Richtlinien, aber der EU-GMP Leitfaden wird weltweit als einer der strengsten angesehen.


