TECHNISCHE DOKUMENTATION SOFTWARE
Digitale Software für Ihre Technische Dokumentation
Die Technische Dokumentation ermöglicht eine umfassende digitale Verwaltung und Aktualisierung aller Dokumente. Dies gewährleistet die Einhaltung von Regularien wie der MDR und steigert gleichzeitig die Effizienz sowie die Datensicherheit Ihrer dokumentationsbasierten Prozesse.
Technische Dokumente effizient und sicher verwalten
Einhaltung der Medical Device Regulation (MDR)
Prozesse digitalisieren und Durchlaufzeiten minimieren

Sie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr Informationen» dls | technical documentation «
Wie unterstützt eine Technische Dokumentation bei der Dokumentation?
Software für Ihre Technische Dokumentation
Vom einzelnen Dokument über unser Dokumentenmanagementsystem bis hin zum prozessorientierten Dossiermanagement — unser Modul „dls | technical documentation“ unterstützt effektiv die Erstellung, Aktualisierung und Verwaltung Ihrer Technischen Dokumentation z. B. im Rahmen der Anforderungen der Medical Device Regulation (MDR). Unser prozessorientiertes Dossiermanagement ist vielseitig einsetzbar, z. B. auch zur Erstellung von Site Master Files, Werkzeuglogbücher, Drug Master Files, QM-Dokumentation, Projektordner, Validierungsdokumentation u.v.m.
Welche Vorteile bietet eine Technische Dokumentation?
Welche Vorteile bietet die Software Technische Dokumentation?
Digitale Verwaltung
Lassen Sie manuell geführte Dokumentationen zu Dossiers der Vergangenheit angehören – Verwalten Sie diese stattdessen vollkommen digital.
Strukturierte Datenpflege
Lassen Sie unaufgeräumte Fileserver mit Mehrfachablagen und redundanten Ordnerstrukturen der Vergangenheit angehören.
Erhöhte Datensicherheit
Schützen Sie Ihre Daten vor unerwünschten Handlungen nicht autorisierter Benutzer sowie vor zerstörerischen Kräften.
Individuelle Konfiguration
Lassen Sie die Module nach Ihren spezifischen Anforderungen konfigurieren, um die Einarbeitung Ihrer Kollegen zu erleichtern.
Erfüllung Medical Device Regulation
Erstellen und aktualisieren Sie Ihre Technische Dokumentation digital, um den Vorgaben der MDR gerecht zu werden.
Minimierung von Durchlaufzeiten
Reduzieren Sie die Prozesslaufzeiten zur Erstellung, Überarbeitung und Freigabe Ihrer Dossiers und minimieren Sie den Zeitaufwand für die Suche und Zusammenstellung aktueller Dokumente.
Zentrale Informationsplattform
Nutzen Sie d.velop documents (ehemals d.3ecm) als Ihre zentrale Informationsquelle, um alle relevanten Daten jederzeit abrufen zu können.
Stetige Verfügbarkeit
Greifen Sie jederzeit und überall auf Ihre Daten zu.
Technische Dokumentation Software Demo
Digitalisieren Sie Ihre Prozesse für mehr Effizienz
Wie arbeite ich mit einer Software für die Technische Dokumentation?
Entdecken Sie einige Features der Technischen Dokumentation
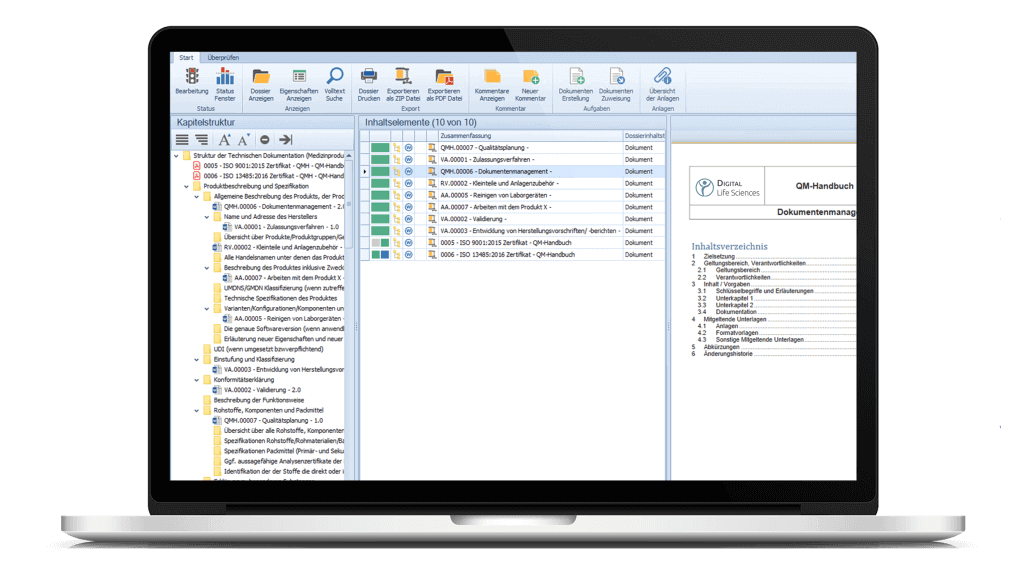
Mittels der Dossiervorlage können Dokumente aus dem eDMS/eQMS bereits in die Struktur übernommen werden. Fügen Sie weitere Dokumente und Anlagen der Dossieranwendung hinzu und ordnen Sie diese den jeweiligen Kapiteln per Drag & Drop zu.
Drucken Sie Ihre Dossiers oder exportieren Sie diese als ZIP-Datei oder PDF/A. Es besteht zudem die Möglichkeit lediglich Teile bzw. bestimmte Kapitel des Dossiers zu drucken und/oder zu exportieren.
Über die Drop Zone können gelenkte und nicht gelenkte Dokumente per Drag & Drop dem Dossier hinzugefügt werden. Dokumente können auch direkt den jeweiligen Knoten/Kapiteln im Dossier via Drag & Drop zugeordnet werden.
Zu jedem Dokument kann eine Vorschau innerhalb des flexibel anpassbaren Lesebereiches angezeigt werden.
Erstellen Sie Vorlagen und Kapitelstrukturen für Ihre Dossiers gemäß Ihren Bedürfnissen und legen Sie Verantwortlichkeiten für die einzelnen Bereiche fest. Dossier-Templates, z. B. für die MDR-Baumstruktur, sind automatisch enthaltener Auslieferungsgegenstand bei der Einführung des Moduls.
Wie sieht eine Technische Dokumentation Software live aus?
Wünschen Sie einen Live-Einblick zur Software?
Erhalten Sie in nur 45 Minuten einen Live-Einblick in die Möglichkeiten eines prozessorientierten Dossiermanagements anhand eines Musteranwendungsfalles. Erfahren Sie, wie unsere Lösung die Erstellung und Aktualisierung Ihrer Technischen Dokumentation im Rahmen der Anforderungen der Medical Device Regulation (MDR) unterstützen und vereinfachen kann.
Welche Funktionen hat eine Technische Dokumentation Software?
Auszug einiger Features der Technischen Dokumentation
- Vorlagenmanagement für diverse Dossierstrukturen
- Aufgabenmanagement für die Bearbeitung einzelner Kapitel eines Dossiers (Workflow)
- Nahtlose Integration in unser Modul Dokumentenlenkung
- Vollständigkeitsprüfung Ihrer Dossiers
- Kontrolle des aktuellen Bearbeitungsstands Ihrer Dossiers
- Versionierung Ihrer Dossiers mit einfachem Zugriff auf alle alten Versionsstände
- Priorisierbare Kommentare
- Export des gesamten Dossiers oder ausgewählter Abschnitte als PDF- oder ZIP-Datei
- Druck des Gesamtdossiers oder selektierter Bereiche des Dossiers
- Integrierte elektronische und GxP-konforme Signatur sowie Audit-Trail Funktion
- Klassifizierung der Dossiers über Attribute im ECM d.velop documents (ehemals d.3ecm)
Welche Regularien muss eine Technische Dokumentation erfüllen?
Regulatorische Anforderungen der Technischen Dokumentation
ISO 13485 MPG
Medical Device Regulation (MDR) - EU-Richtlinie MDR 2017/745
33 Gute Gründe für eine Zusammenarbeit mit Digital LS
Sie sind noch nicht überzeugt? Erfahren Sie 33 Gute Gründe, die für eine Zusammenarbeit mit der Digital Life Sciences GmbH sprechen. Dabei zeigen wir Ihnen sowohl Gründe aus Anbietersicht, aus Softwaresicht sowie weitere allgemeine Gründe, die uns auszeichnen.
Welche Unternehmen setzen eine Technische Dokumentation ein?
Kundenmeinung zur Technischen Dokumentation
“Wir arbeiten seit Jahren sehr erfolgreich und zufrieden mit der d.velop AG zusammen. Auf der Suche nach einem zuverlässigen Partner für die technische Dokumentation unserer gesamten Medizinprodukte sind wir auf den Life Sciences Client gestoßen. Mit der Umstellung auf die neue Struktur der EU MDR konnten wir das Potenzial vom Life Sciences Client für uns vollständig nutzen und somit die Arbeit bei der Dokumentenerstellung erleichtern und die Akzeptanz im Unternehmen verbessern."

Welche Software kann mit einer Technischen Dokumentation Software gemeinsam eingesetzt werden?
Das könnte Ihnen auch gefallen ...
Die Technische Dokumentation ist ein Baustein der Digital Life Sciences Lösungssuite. Jedes Produkt für sich ist schon leistungsstark, gemeinsam eingesetzt sind sie sogar noch besser.

Dokumentenlenkung Software
Ob Arbeits- / Verfahrensanweisung (SOP’s), Prozessbeschreibungen, Prüfvorschriften oder andere Dokumenttypen — alle erstellen, revisionieren und unterschreiben Sie digital mit der Software Dokumentenlenkung.

Schulungsmanagement Software
Erweitern Sie das Modul “Dokumentenlenkung” um die aktive Planung und Protokollierung der Qualifikationen Ihrer Mitarbeiter mit unserer Schulungsmanagement Software.

QM-Prozesse (Complaint | DC | CAPA | CC)
Digitalisieren Sie Ihre ISO-Prozesse. Steuern Sie Ihre produktionsbegleitenden QM-Prozesse mittels digitaler Workflows.
Technische Dokumentation FAQ
Häufig gestellte Fragen (FAQ's) zur Technischen Dokumentation
- Gibt es Templates für die Struktur des Dossiers?
Für häufig verwendete Dokumentationen wie z. B. nach Anhang II der MDR 2017/745 sind Templates vorhanden. Auf Basis einer von ihnen verwendeten Struktur können Sie auch selbst Templates ergänzen oder im Rahmen der Einführung des Moduls erstellen lassen.
- Können Kapitelstrukturen angepasst werden?
Kapitelstrukturen und Dossier-Vorlagen können Sie selbst anpassen oder auch eigene Vorlagen erstellen.
- Gibt es Vorlagen oder Beispiele für die technische Dokumentation?
Viele Anbieter von Dokumentationssoftware offerieren umfassende Vorlagen und Beispiele, um den Dokumentationsprozess effizient zu gestalten. Dazu gehören:
Technische Dokumentationsvorlagen: Diese sind bereits strukturiert und enthalten häufig verwendete Felder, die eine konsistente und normgerechte Erstellung von Dokumenten gewährleisten.
Word-Vorlagen für technische Dokumentationen: Diese Vorlagen sind besonders für kleinere Projekte geeignet und ermöglichen eine einfache Anpassung an spezifische Anforderungen.
Beispiele für eine Technische Dokumentation im PDF-Format: Diese dienen als wertvolle Orientierungshilfe hinsichtlich der Struktur und Inhalte und unterstützen die Benutzer dabei, qualitativ hochwertige Dokumente zu erstellen.
- Wie stelle ich sicher, dass ein Mitarbeiter alle relevanten Dokumente in das Dossier einfügt?
Über die Aufgaben ‚Platzhalter‘ und ‚Dokumentenerstellung‘ geben Sie vor, welche Dokumente das Dossier enthalten muss, bevor es frei gegeben werden kann.
- Kann ich Dokumente aus dem File-System im Dossier verwenden?
Dokumente von Ihrem Desktop oder aus dem Dateiverzeichnis können Sie im Dossier verwenden. Sie werden im Dokumenten-Management-System abgelegt und von dort in einem oder mehreren Dossiers verwendet.
- Können mehrere Mitarbeiter an einem Dossier arbeiten?
Für jedes Dossier wird ein Hauptverantwortlicher festgelegt, der auch die Erinnerungen für die Fertigstellung oder die periodische Prüfung erhält. Einzelne Kapitel der Struktur können einem Teilverantwortlichen zur Bearbeitung übergeben werden.
- Können Dokumente mehrfach verwendet werden?
Dokumente werden einmal in die Inhaltsliste des Dossiers aufgenommen und können dann an mehreren Stellen in der Struktur eingefügt werden. Dokumente können auch in mehreren Dossiers Verwendung finden.
- Warum nutzt man die Technische Dokumentation zur Zulassung eines Medizinproduktes?
Die Technische Dokumentation wird für die Zulassung eines Medizinprodukts verwendet, um den Aufsichtsbehörden und anderen beteiligten Personen Informationen darüber zu liefern, wie das Produkt funktioniert, wer es verwenden wird und wie es sicher verwendet werden kann.
- Wie kann unsere Software Sie bei der technischen Dokumentation unterstützen?
Unsere Technische Dokumentation Software ist eine Anwendung, die primär für die Verwaltung von technischen Dokumentationen (“Dossiers”) verwendet wird. Sie kann dabei eine Vielzahl von Dossiers verwalten. Die Software erlaubt Ihnen zum Beispiel die Erstellung einer technischen Dokumentation gemäß MDR (EU Medizinprodukte-Verordnung). Das Ziel ist hierbei die revisionssichere Verwaltung sämtlicher Dokumente und Inhalte, die im Leben eines Medizinproduktes anfallen.
Wie Sie zukünftig als Anwender von unserer Software für die Technische Dokumentation in Ihrem Unternehmen profitieren können, zeigen wir Ihnen gerne in einem Live-Webcast zur Software.
- Was sind die wesentlichen Aspekte bei der Verwaltung von Dokumentationssoftware für Medizinprodukte?
Bei der Verwaltung von Dokumentationen für Medizinprodukte sind folgende Aspekte von entscheidender Bedeutung:
- Die Software sollte umfassende Funktionen wie die Versionierung, einen Freigabeprozesse sowie eine vollständige Software-Dokumentation unterstützen.
- Die Einhaltung regulatorischer Vorgaben, einschließlich der Anforderungen an die technische Dokumentation und der Richtlinien zur Software-Dokumentation, ist unerlässlich, um die Konformität und Qualität zu gewährleisten.
- Welche Anforderungen muss eine technische Dokumentation für Medizinprodukte erfüllen?
Die Anforderungen an eine Technische Dokumentation für Medizinprodukte umfassen u.a.:
- Vollständige und transparente Darstellung der Produktinformationen, z. B. in Übereinstimmung mit der Medical Device Regulation (MDR).
- Nahtlose Integration der Produktdokumentation für Medizinprodukte sowie spezifische Testberichte.
- Gewährleistung der Nachverfolgbarkeit, z. B. durch die Verwendung von Templates für die technische Dokumentationen.
- Einsatz einer speziellen Software-Dokumentations-Vorlage, um den regulatorischen Anforderungen gerecht zu werden.
- Wie kann man eine technische Dokumentation erstellen und welche Tools gibt es dafür?
Für die Erstellung technischer Dokumentation stehen Ihnen verschiedene Ansätze zur Verfügung:
- Manuelle Erstellung mithilfe von spezifischen Word-Vorlagen für die technische Dokumentation.
- Einsatz spezialisierter Softwarelösungen für die technische Dokumentation, die vorgefertigte Vorlagen und umfassende Strukturierungsmöglichkeiten bieten, um den dokumentierten Prozessen gerecht zu werden.
- Erstellung der technischen Dokumentation in PDF-Formaten, um eine einfache Verteilung und langfristige Archivierung sicherzustellen.
Darüber hinaus sind Schulungen von großer Bedeutung, wie beispielsweise Schulungen zur technischen Dokumentation für Medizinprodukte. Diese Schulungen fördern das Verständnis für branchenspezifische Standards und regulatorische Anforderungen und tragen zur Qualitätssicherung bei.
- Werden die Dokumente im Dossier bei neuen Versionen aktualisiert?
Bei Freigabe eines Dossiers wird die Version ‚eingefroren‘, Änderungen sind nur in einer Folgeversion möglich. Mit der Übersicht ‚Versionsstände‘ erhalten Sie eine Übersicht der Dokumentenversionen. Um neue Versionen zu übernehmen, erstellen Sie eine neue Version des Dossiers und entscheiden, welche Version der Dokumente sie übernehmen.
Bei Dokumenten, die dem Dossier als Anlage hinzugefügt wurden, wird immer die gültige Freigabeversion verwendet.
- Können einzelne Dokumente aus dem Dossier gedruckt werden?
Der Druck von Dokumenten ist möglich, die Funktion richtet sich nach den Vorgaben aus dem Dokumenten-Management-System (kontrolliert – nicht kontrolliert).
- Ist ein Teilexport des Dossiers möglich?
Der Export als ZIP-Archiv oder PDF-Datei ist für das ganze Dossier oder für ausgewählte Kapitel / Dokumente möglich.
- Sind die aus dem Dossier exportierten Daten geschützt?
Für die ZIP-Datei ist die Absicherung mit einem Passwort vorbelegt, zusätzlich können Sie die Erstellung von PDF/A Dateien vorgeben, um Druck und Kopieren zu verhindern und bei jedem Export ein Wasserzeichen eingeben.
- Wird der Export protokolliert?
Im Audit Trail des Dossiers werden die Aktionen festgehalten, einschließlich der Ausgabe als ZIP- oder PDF-Datei und dem Export einzelner Dokumente. Das Audit Trail speichert das Datum und die Uhrzeit einer Aktivität zu den unten aufgeführten Aktionen. Weiterhin wird die Kennung des Mitarbeiters, welcher Auslöser für die Aktivität war, im Audit Trail Eintrag gespeichert.
- Welche Dateiformate können im Dossier verwendet werden?
Dokumente können unabhängig vom Dateiformat in das Dossier eingefügt werden (PDF, MS Word, Excel, PowerPoint, PNG, JPG, TIFF, Visio)
Übersicht Medical Device Regulation (MDR)
Die Medizinprodukteverordnung (MDR) ist seit dem 26. Mai 2021 in der Europäischen Union (EU) gültig. Dieser Artikel bietet Informationen zu ihrem Inhalt und den Umsetzungsbestimmungen für die Medizintechnikbranche.
Die “Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates über Medizinprodukte” trat bereits am 5. April 2017 in Kraft. Sie tritt an die Stelle der bisherigen “Richtlinie 93/42/EWG über Medizinprodukte”. Konkret bedeutet dies für den Bereich der Medizintechnik, dass die EU-Verordnung 2017/745 folgende bisherige Richtlinien ablöst:
- Richtlinie 93/42/EWG über Medizinprodukte (MDD);
- Richtlinie 90/385/EWG, aktive implantierbare Medizinprodukte – Active Implantable Medical Devices (AIMDD).
Die EU-Gremien entschieden sich für eine separate Regelung in Bezug auf die Richtlinie 98/79/EG über In-vitro-Diagnostika (IVD). Diese Richtlinie wurde nicht in die Medizinprodukteverordnung übernommen. An ihre Stelle tritt die separat formulierte EU-Verordnung “In-vitro Diagnostic Medical Devices Regulation 2017/746 (IVDR)”.
Im Gegensatz zur abgelösten Richtlinie hat die neue Verordnung des EU-Parlaments internationale Bedeutung erlangt. Ihre verbindliche Gültigkeit erstreckt sich ab dem Stichtag 26. Mai 2021 auf alle EU-Mitgliedstaaten. Es ist zu beachten, dass bis Oktober 2019 noch keine nationalen Rechtsakte der einzelnen Mitgliedsstaaten beschlossen wurden. Dies gilt auch für deutsche Besonderheiten, Anforderungen und zu erlassende Vorschriften. Es liegt zwar ein entsprechender Entwurf für ein deutsches Durchführungsgesetz vor, doch rechnet das Bundesgesundheitsministerium mit Übergangsfristen.
Gemäß dem vorliegenden Gesetzestext gilt bei der Umsetzung eine Übergangsfrist von drei Jahren (26.05.17 – 25.05.21*). Spätestens seit dem Ablauf der Frist sind Hersteller verpflichtet, ein MDR-Zertifikat vorzulegen. Nur so ist es ihnen erlaubt, ein Produkt erstmalig auf den Markt zu bringen.
*Im Zuge der COVID-19-Pandemie wurde der Geltungsbeginn der Verordnung auf den 26. Mai 2021 verschoben.
Im Kern zielt die neue Verordnung auf eine optimierte, einheitliche Regelung für die Markteinführung von Produkten der Medizintechnik ab. Im Fokus stehen dabei die Faktoren Produktsicherheit und Produktqualität. Für Marktteilnehmer und Anwender besteht die neue EU-Verordnung aus einer Mischung aus bekannten Inhalten der früheren Richtlinie 93/42/EWG und weitreichenden Neuerungen. Zu den wesentlichen inhaltlichen und verfahrenstechnischen Aspekten für Sie und Ihre Branche gehören die folgenden Inhalte der Brüsseler Verordnung:
Regeln zur Klassifizierung von Medizinprodukten
Neue Begriffe und Regeln führen zu Veränderungen bei der Zuordnung bestehender Produkte zu teilweise geänderten Produktklassen. Von diesen Veränderungen ist beispielsweise der Produktbereich der “Stand-alone”-Software betroffen.
Verfahren zur Konformitätsbewertung
In Anlehnung an das Regelwerk für die Klassifizierung unterscheidet sich nun auch das Konformitätsbewertungsverfahren je nach Klasse.
Technische Dokumentation/Dokumenten Management System
Die technische Dokumentation nach der Medizinprodukteverordnung erweist sich als wesentlich detaillierter. Vorteile bei der Kontrolle und Dokumentation für Unternehmen werden deutlich, wenn man sich das neu zugrundeliegende, tabellarisch strukturierte Schema im Detail ansieht. Die Unterteilung in einzelne Kategorien in direkter Verknüpfung mit den zugehörigen detaillierten Anforderungen bildet die Grundlage für eine detaillierte technische Dokumentation.
Klinische Bewertungen/klinische Prüfungen
Deutlich erhöhte Anforderungen kennzeichnen diesen Aktionspunkt. Dies gilt insbesondere für risikoreiche Produktgruppen.
Firmenverantwortung/Sicherheitsbeauftragter
Eine wesentliche Änderung für Ihr Unternehmen ergibt sich aus der Forderung der EU-Gremien nach einer verantwortlichen Person, die für die Einhaltung der regulatorischen Anforderungen in ihrer Organisation zuständig ist.
Qualitätsmanagement
Die FDA Medical Device 21 CFR 820 (FDA = U.S. Food and Drug Administration) formuliert die Anforderungen an Managementsysteme von Medizinprodukteherstellern. In dieser Funktion ist Device 21 CFR 820 ein Pendant zur ISO 13485. Kernanforderung ist, dass Verfahrensanweisungen wie Dokumentenlenkung, Beschaffung, Entwicklung sowie Produktion dokumentiert und analog umgesetzt werden.
Marktüberwachungsmechanismen
Insbesondere die verpflichtende Nutzung der EUDAMED-Datenbank sorgt für mehr Transparenz. Sie steht sowohl der Öffentlichkeit als auch den direkten Wettbewerbern als Informationsmedium zur Verfügung. Durch entsprechende Verknüpfungen werden die Merkmale jedes Medizinprodukts abgebildet. Auch die Rückverfolgung von Lieferketten ist möglich
Im Interesse der rechtzeitigen Einhaltung der neuen Verordnung sind Sie die verantwortliche Person im Unternehmen. Ein zeitlich und inhaltlich stimmiger Plan für die Umstellung Ihres Unternehmens auf die Medizinprodukteverordnung ist Voraussetzung für Ihren Erfolg. Sie sollten den Lebenszyklen Ihres Medizinprodukteportfolios hohe Priorität einräumen. Bestehende MDD-Zertifizierungen verlieren nach den EU-Vorschriften am 26. Mai 2024 ihre Gültigkeit. Bitte bedenken Sie bei Ihrer Planung, dass Ihre bereits nach MDD zertifizierten Produkte auch das neu zu schaffende Konformitätsverfahren nach MDR durchlaufen müssen. Ein “Grandfathering” ist nicht garantiert.
In der Phase der Umstellung sind Sie in Ihrer Funktion als Hersteller oder Lieferant besonders gefordert. Oberste Priorität hat die Benennung und Schulung der Person, die in Ihrem Unternehmen für die Einhaltung der Vorschriften verantwortlich ist (MDR Artikel 15). Aktualisierungen der internen Qualitätssicherungsverfahren, der Dokumentation und der geänderten Produktklassifizierung sind zwingend erforderlich.
Vor diesem Hintergrund wird das folgende standardisierte Vorgehen nach den folgenden 4 Punkten empfohlen:
- Durchführung der Konformitätsbewertung in Bezug auf das Produkt
- Ausstellung der Konformitätserklärung
- “CE”-Kennzeichnung der Produkte
- Registrierung des Unternehmens und der Produkte in der EUDAMED-Datenbank.
Mit der MDR haben sich die EU-Behörden vorgenommen, eine moderne, einheitliche Lösung für das Qualitätsmanagement und die Marktfreigabe von Medizinprodukten zu schaffen. Der Qualität und Sicherheit der Produkte wird dabei große Aufmerksamkeit geschenkt. Vielleicht gehören auch Sie zu den kleinen und mittleren Unternehmen der Medizintechnikbranche, die eine Überregulierung durch das umfangreiche Regelwerk und zusätzliche Kontrollstellen befürchten?
Insbesondere die Bewertung der Konformität durch den einzustellenden “Compliance Manager” dürfte in der Startphase zu einem personellen Problem werden. Im Härtefall könnte ein Mangel an zertifizierten Prüfern die für die Marktfreigabe notwendige Zertifizierung verzögern. Medizintechnische Industrieverbände äußern die Befürchtung, dass sich ein Engpass bei den Zertifizierungen negativ auf die Markteinführung innovativer und marktfähiger Produkte auswirken könnte.
Schnellkontakt
Sie haben eine Frage zur Technischen Dokumentation?
Unser Vertriebsteam hilft Ihnen zeitnah und gerne weiter.
