Definition des Begriffs („Was ist ein Device Master Record?“)
Als Device Master Record bezeichnet man eine technische Produktakte mit der Zusammenstellung von Dokumenten und Aufzeichnungen, die alle Spezifikationen und Herstellungsverfahren für ein medizinisches Gerät enthalten (FDA 21 CFR 820). Der Begriff Device Master Record wurde von der US-amerikanischen Food and Drug Administration (FDA) geprägt und ist ein Teil der Qualitätssicherungsbestimmungen (QSR).
Welche Verbindung besteht zur FDA?
Da die Entwicklungen im Bereich medizinischer Geräte über die letzten Jahre enorm zugenommen haben, stehen auch die regulierenden Zulassungsbehörden vor ständig neuen Hürden. So fungiert die FDA (Food and Drug Administration) mit ihrer Zuverlässigkeit und ihrer konsequenten Regulation mittlerweile international als Vorbild. In Bezug auf die FDA stellt der Device Master Record einen Aspekt des umfangreichen Dokumentationssystems dar, welches die Regulation der Qualitätssicherung medizintechnischer Geräte zum Ziel hat. Während sich die FDA nur auf Geräte des US-amerikanischen Marktes konzentriert, ist mit der Überarbeitung der ISO 13485(:2016) und dem dort verankerten Medical Device File, nun ebenfalls in Europa eine Dokumentation zur Qualitätssicherung verpflichtend.
Was sind die Bestandteile einer DMR?
Gerätespezifikationen:
- Detaillierte Gerätedesigns und Spezifikationen.
- Materialspezifikationen.
Komponentenzeichnungen und Spezifikationen. - Produktaufkleber und Verpackungsdetails.
Herstellungsverfahren:
- Schritt-für-Schritt-Montageanweisungen.
- Qualitätskontrollverfahren.
Kalibrierungsverfahren. - Test- und Inspektionsprotokolle.
Aufzeichnungen zur Qualitätskontrolle:
- Aufzeichnungen von Qualitätskontrolltests.
- Berichte über Abweichungen und Korrekturmaßnahmen.
- Lieferantenaudits und Zertifikate.
Aufzeichnungen zur Gerätehistorie:
- Produktionsaufzeichnungen für jede Charge.
- Aufzeichnungen zur Geräteverteilung.
- Beschwerden und Rücksendungsdokumentation.
Aufzeichnungen zur Kennzeichnung und Verpackung:
- Kennzeichnungsdesign und Inhalt.
- Verpackungsspezifikationen.
- Gebrauchsanweisungen und Sicherheitsinformationen.
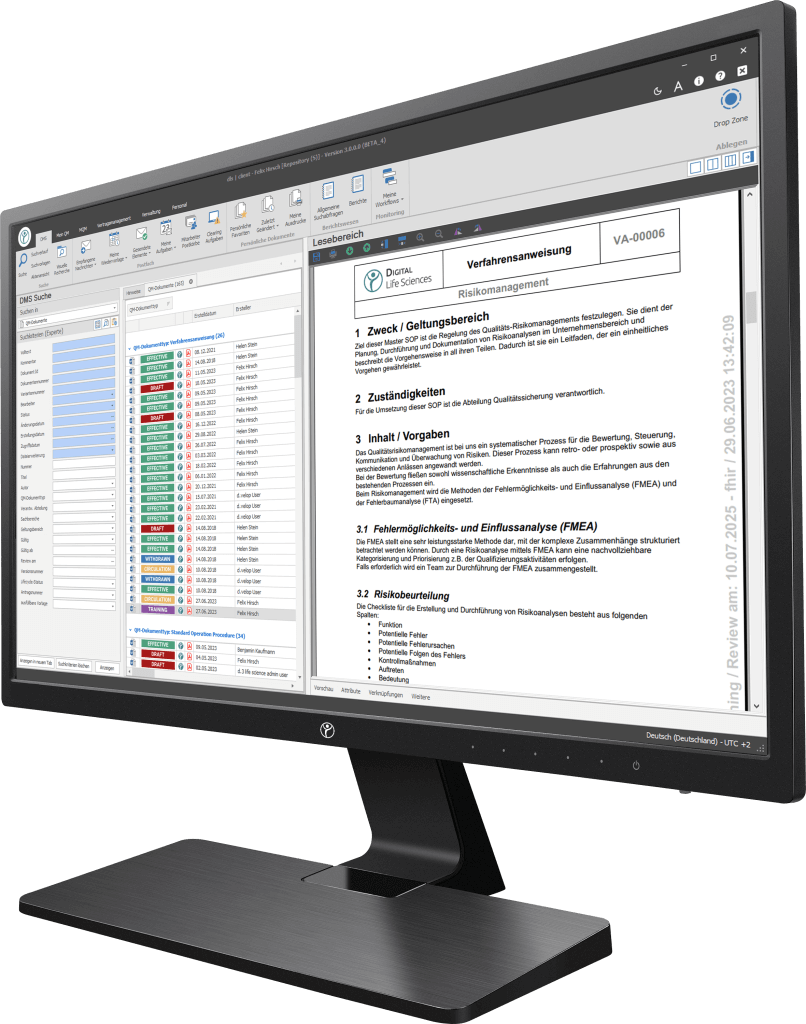
Ihr Weg in die Digitalisierung - Entdecken Sie unsere Software
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
Warum ist eine Device Master Record (DMR) wichtig?
- Gewährleistung der Konsistenz: Eine gut gepflegte DMR ist entscheidend, um sicherzustellen, dass jedes hergestellte Gerät in Design, Qualität und Leistung konsistent ist. Diese Konsistenz ist entscheidend, um die Erwartungen der Kunden und regulatorischen Anforderungen zu erfüllen.
- Regulatorische Einhaltung: Regulierungsbehörden wie die FDA in den Vereinigten Staaten verlangen von Herstellern von medizinischen Geräten, eine DMR aufrechtzuerhalten. Die Einhaltung dieser Vorschriften ist nicht verhandelbar, und eine robuste DMR ist der Schlüssel zur Erfüllung dieser Anforderungen.
- Rückverfolgbarkeit und Verantwortlichkeit: Im Falle von Produktproblemen oder Rückrufen ermöglicht eine DMR, Herstellern, die Ursache des Problems zurückzuverfolgen. Diese Rückverfolgbarkeit ist entscheidend für die Verantwortlichkeit und kontinuierliche Verbesserung.
- Effizienz und Kostensenkung: Effiziente Herstellungsprozesse führen zu Kosteneinsparungen. Eine gut organisierte DMR optimiert die Produktion, reduziert Fehler und minimiert Abfälle, was letztendlich zu Kosteneinsparungen führt.
Wie erstelle ich eine DMR?
Dokumentenkontrolle:
- Implementieren Sie eine qualitative Dokumentenlenkung, um DMR-Komponenten effizient zu verwalten.
- Stellen Sie sicher, dass alle Änderungen an der DMR dokumentiert, überprüft und genehmigt werden.
Versionskontrolle:
- Behalten Sie die Versionskontrolle bei, um die Verwendung veralteter Dokumente oder Verfahren zu verhindern.
- Archivieren Sie ältere Versionen zur Referenz.
Zusammenarbeit in übergreifenden Teams:
- Binden Sie übergreifende Teams in die Erstellung und Pflege der DMR ein, einschließlich Design, Produktion und Qualitätskontrolle.
Regelmäßige Audits:
- Führen Sie regelmäßige interne Audits durch, um die Genauigkeit und Vollständigkeit der DMR zu überprüfen.
- Bearbeiten Sie Abweichungen umgehend.
Fazit
Im Bereich der Herstellung von medizinischen Geräten steht die technische Produktakte (DMR) als Grundpfeiler für Qualität, Konsistenz und regulatorische Einhaltung. Durch die akribische Dokumentation jedes Aspekts von Gerätedesign, Produktion und Qualitätskontrolle können Hersteller die Sicherheit und Wirksamkeit ihrer Produkte gewährleisten.
Denken Sie daran, eine gut gepflegte DMR erfreut nicht nur die Regulierungsbehörden, sondern trägt auch zum Erfolg und zur Reputation Ihrer Organisation bei. Akzeptieren Sie daher die DMR als Ihren Verbündeten bei der Bereitstellung erstklassiger medizinischer Geräte für die Welt.
Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Ist eine Device Master Record (DMR) für alle medizinischen Geräte obligatorisch?
Ja, eine DMR ist eine regulatorische Anforderung für alle medizinischen Geräte, um deren Qualität und Sicherheit zu gewährleisten.
Wie oft sollte eine DMR aktualisiert werden?
DMRs sollten aktualisiert werden, wenn es Änderungen an Gerätespezifikationen, Herstellungsprozessen oder Qualitätskontrollverfahren gibt.
Kann eine DMR im elektronischen Format sein, oder ist eine physische Aufzeichnung erforderlich?
DMRs können im elektronischen Format vorliegen, solange sie die regulatorischen Anforderungen an Datensicherheit und Integrität erfüllen.
Was passiert, wenn ein Unternehmen es versäumt, eine DMR aufrechtzuerhalten?
Das Versäumnis, eine DMR aufrechtzuerhalten, kann zu regulatorischer Nichtkonformität, Produktrückrufen und rechtlichen Konsequenzen führen.


