Definition des Begriffs („Was ist ein Qualitätsmanagement Handbuch?“)
Ein Qualitätsmanagement-Handbuch (QM-Handbuch) ist ein zentrales Dokument, das das Qualitätsmanagementsystem (QMS) eines Unternehmens beschreibt. Es dient als Leitfaden für die Umsetzung und Aufrechterhaltung des Qualitätsmanagements und stellt sicher, dass alle relevanten Prozesse, Verantwortlichkeiten und Verfahren klar definiert sind. Zudem reflektiert das Handbuch die Managementeinstellung zur Qualität und beschreibt die daraus resultierenden Maßnahmen zur Sicherstellung der Produkt- oder Dienstleistungsqualität. Es fungiert auch als wichtiger Orientierungspunkt für Mitarbeiter und Auditoren, um einen schnellen und umfassenden Überblick über das Qualitätsmanagementsystem zu erhalten.
Wofür benötigt man ein QM-Handbuch?
Die Kernidee eines QM-Handbuches ist die kompakte Zusammenfassung des Managementsystems an einem zentralen Ort innerhalb des Unternehmens. Es soll gleichermaßen mit mitgeltenden Dokumenten, wie z.B. Verfahrens- und Arbeitsanweisungen, jedem Mitarbeiter zur Verfügung gestellt werden. Darüber hinaus wird es für die Einführung beteiligter Mitarbeiter und Auditoren benötigt, um kurzfristig gebündelt Informationen und Inhalte des QM-Systems vermitteln zu können.
Ist ein QM-Handbuch verpflichtend?
ISO 9001: Während das QM-Handbuch in der EN ISO 9001 noch unerlässlich war, ist es seit der Revision ISO 9001:2015 nicht mehr zwingend erforderlich. Dieses war bisher das Hauptinstrument, mit dem Unternehmen das QM-System und damit die Strukturen und Abläufe im Unternehmen abgebildet haben. Jetzt entscheiden Unternehmen selbst, welche Abläufe und Prozesse intern dokumentiert werden und wie sie Abläufe aufgliedern und beschreiben.
Die neue ISO 9001:2015 erlaubt somit eine zeitgerechtere (größtenteils IT-gestützte), dynamischere und freiere Aufzeichnung des QM-Systems. Jedoch kann das bestehende QM-Handbuch an die Erfordernisse der ISO 9001:2015 angeglichen werden und weiterhin als Motivations- und Informationswerkzeug fungieren.
MDR und IVDR: Die Medizinprodukteverordnungen der Europäischen Union, bekannt als MDR (Medical Device Regulation) und IVDR (In Vitro Diagnostic Regulation), stellen einen grundlegenden Rahmen für die Sicherheit und Qualität von Medizinprodukten sowie In-vitro-Diagnosetests dar. In den Anhängen IX dieser Verordnungen wird ausdrücklich auf die Notwendigkeit eines Qualitätsmanagementhandbuchs hingewiesen, welches im Abschnitt 2.2 detailliert beschrieben wird.
ISO 13485: Die ISO 13485 präzisiert in Kapitel 4.2.2, betitelt „Qualitätsmanagement-Handbuch“, die Anforderungen an die Erstellung sowie den Inhalt eines Qualitätsmanagement-Handbuchs. Gemäß den Vorgaben dieser Norm ist es unerlässlich, dass das Qualitätsmanagement-Handbuch spezifische Regelungen und Informationen bereitstellt. Zu den wesentlichen Aspekten, die behandelt werden müssen, zählen:
- Anwendungsbereich: Eine klare Definition des Anwendungsbereichs, einschließlich aller etwaigen Ausschlüsse.
- Verfahrensdefinition: Eindeutige und detaillierte Beschreibung der im Qualitätsmanagementsystem implementierten Verfahren.
- Prozessinteraktionen: Detaillierte Erläuterung der Wechselwirkungen zwischen den verschiedenen Prozessen innerhalb des Qualitätsmanagementsystems.
- Dokumentationsstruktur: Festlegung einer klaren und nachvollziehbaren Struktur der Dokumentation.
Was beinhaltet ein QM-Handbuch?
Neben den Informationen zur Qualitätspolitik und zu den Qualitätszielen, beinhaltet ein QM-Handbuch ebenfalls eine Übersicht über:
- Aufbau der Firmenorganisation
- Belegte Rollen innerhalb des QM-Systems
- Dokumentenanordnung des QM-Systems
- Verfahrensanweisungen
- Arbeits-, Sicherheits- und Prüfanweisungen
- Qualitätsaufzeichnungen
Was sind die Vorteile eines QM-Handbuches?
- Es dient zur Außendarstellung des eigenen QM-Systems im Sinne der Zertifizierung sowie der Absatzförderung
- Es dient der kontinuierlichen Qualitätsverbesserung, die durch eine explizite Analyse und Beschreibung aller qualitätsrelevanten Prozesse fortlaufend weiterentwickelt wird
- Es fungiert zum Nachweis der Wirksamkeit von Maßnahmen mittels Soll-Ist-Vergleich
- Es motiviert die Mitarbeiter, da diese aktiv an der Erstellung eines QM-Systems beteiligt sind und somit zum qualitätsbewussten Denken und Handeln motiviert werde
Ihr Weg in die Digitalisierung - Entdecken Sie unsere Software
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
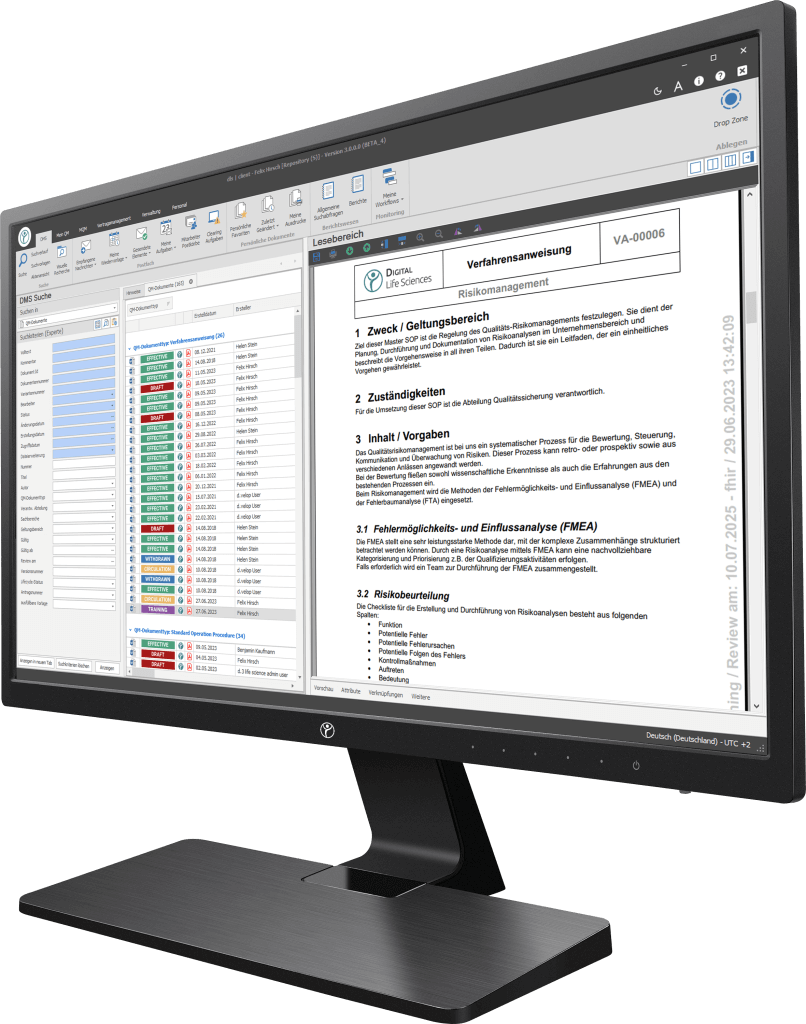
Was ist ein elektronisches Qualitätsmanagementhandbuch?
Mit der fortschreitenden Digitalisierung setzen immer mehr Unternehmen auf elektronische Qualitätsmanagementhandbücher. Diese bieten den Vorteil einer einfachen Aktualisierung, besseren Zugänglichkeit und der Integration in bestehende IT-Systeme wie ERP oder DMS. Ein elektronisches QMH ermöglicht es, Änderungen in Echtzeit zu verfolgen und sicherzustellen, dass alle Mitarbeiter stets Zugriff auf die neuesten Informationen haben.
Best Practices für ein effektives Qualitätsmanagementhandbuch
- Klarheit und Verständlichkeit: Das Handbuch sollte klar und verständlich formuliert sein, um Missverständnisse zu vermeiden.
- Regelmäßige Aktualisierung: Ein QMH muss regelmäßig überprüft und aktualisiert werden, um den aktuellen Standards und Unternehmensprozessen zu entsprechen.
- Mitarbeiterbeteiligung: Die Einbindung der Mitarbeiter bei der Erstellung und Pflege des QMH fördert das Qualitätsbewusstsein und die Akzeptanz im Unternehmen.
- Audit- und Überwachungsmechanismen: Regelmäßige Audits und Überwachungen stellen sicher, dass das Qualitätsmanagementhandbuch (QM-Handbuch) effektiv implementiert und genutzt wird.
Fazit
Ein Qualitätsmanagementhandbuch (QMH) ist ein unverzichtbares Instrument für jedes Unternehmen, das seine Qualitätsstandards aufrechterhalten und kontinuierlich verbessern möchte. Es dient als umfassendes Nachschlagewerk für alle qualitätsrelevanten Prozesse und Maßnahmen. Die Einführung eines elektronischen QMH bietet zusätzliche Vorteile wie einfache Aktualisierungen und bessere Zugänglichkeit. Durch regelmäßige Überprüfung und Mitarbeitereinbindung stellt das QMH sicher, dass Qualitätsziele erreicht und Standards eingehalten werden, was letztendlich zur Stärkung der Wettbewerbsfähigkeit und des Kundenvertrauens beiträgt.Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Welche Grundelemente beinhaltet ein QM-Handbuch?
Das QM-Handbuch umfasst mehrere Grundelemente des Qualitätsmanagements. Dazu gehören:
- QM-Politik und -Ziele
- Beschreibung der Hauptprozesse und deren Interaktionen
- Rollen und Verantwortlichkeiten
- Verfahren zur Dokumentenlenkung
- Methoden zur Überwachung und Messung der Qualitätsleistung
Was ist das Ziel eines Qualitätsmanagement-Handbuchs?
- Das Ziel eines Qualitätsmanagement-Handbuchs ist es, eine zentrale Referenz für alle Aspekte des Qualitätsmanagements innerhalb einer Organisation bereitzustellen. Es dient dazu, Konsistenz und Transparenz zu gewährleisten, indem es klare Anweisungen für Qualitätskontrollen und -verbesserungen bietet.
Wie ist der Aufbau eines Handbuchs für Qualitätsmanagement?
Der Aufbau eines Handbuchs für Qualitätsmanagement kann variieren, aber typischerweise besteht es aus folgenden Abschnitten:
- Einführung und Geltungsbereich
- Leitbild und Qualitätsziele
- Übersicht der Kernprozesse und Verfahren
- Verantwortlichkeiten und Zuständigkeiten
- Dokumentenkontrolle und Aufzeichnungen
- Korrektur- und Vorbeugungsmaßnahmen (CAPA)
- Überwachung, Messung und Analyse
Was ist der Unterschied zwischen einem QM-Handbuch und einem QM-Management-Handbuch?
- Die Begriffe QM-Handbuch und QM-Management-Handbuch werden häufig synonym verwendet. Beide beziehen sich auf das zentrale Dokument, das die Richtlinien und Verfahren des Qualitätsmanagementsystems beschreibt. Der Begriff „QM-Management-Handbuch“ betont jedoch stärker die Managementaspekte und die strategische Bedeutung des QMS innerhalb der Organisation.
Warum ist ein Qualitätsmanagementhandbuch wichtig?
- Ein Qualitätsmanagementhandbuch ist wichtig, weil es die Grundlage für das Qualitätsmanagementsystem eines Unternehmens bildet. Es hilft dabei, einheitliche Qualitätsstandards zu setzen und zu bewahren, die Einhaltung gesetzlicher und regulatorischer Anforderungen sicherzustellen und kontinuierliche Verbesserungen zu fördern.
Was beinhaltet die QM-Dokumentation?
- Die QM-Dokumentation Definition bezieht sich auf alle dokumentierten Informationen, die notwendig sind, um das Qualitätsmanagementsystem zu unterstützen und nachzuweisen. Dazu gehören das QM-Handbuch, Prozessbeschreibungen, Verfahrensanweisungen, Arbeitsanweisungen, Formulare und Aufzeichnungen.
Welchen Nutzen hat ein gut strukturiertes QM-Management-Handbuch für Unternehmen?
Ein gut strukturiertes QM-Management-Handbuch bietet zahlreiche Vorteile:
- Erhöhte Effizienz durch klare und standardisierte Prozesse
- Verbesserung der Produktqualität und -sicherheit
- Erleichterung der Schulung neuer Mitarbeiter
- Unterstützung bei internen und externen Audits
- Einhaltung gesetzlicher und regulatorischer Anforderungen


