Definition des Begriffs: Was ist der EU-GMP-Leitfaden Annex 11?
Der Annex 11 des EU-GMP-Leitfadens ist speziell auf computergestützte Systeme und elektronische Aufzeichnungen ausgerichtet. Er wurde entwickelt, um sicherzustellen, dass diese Systeme den Anforderungen der Guten Herstellungspraxis (GMP) entsprechen. In der heutigen digitalen Welt, in der Daten von entscheidender Bedeutung sind, ist der Annex 11 von zentraler Bedeutung.
Hauptanforderungen des EU-GMP-Leitfadens Annex 11
Der Annex 11 legt spezifische Anforderungen an die elektronische Datenerfassung und -verarbeitung in pharmazeutischen Unternehmen fest. Einige der Hauptanforderungen sind:
- Validierung elektronischer Systeme: Pharmazeutische Unternehmen müssen sicherstellen, dass ihre elektronischen Systeme validiert sind. Dies bedeutet, dass die Systeme ordnungsgemäß getestet und dokumentiert werden müssen, um ihre Integrität und Zuverlässigkeit sicherzustellen.
- Elektronische Aufzeichnungen: Der Annex 11 fordert, dass elektronische Aufzeichnungen sicher, lesbar und rückverfolgbar sind. Dies ist entscheidend, um die Integrität von Daten zu gewährleisten und sicherzustellen, dass sie im Falle einer Inspektion verfügbar sind.
- Zugriffskontrolle: Pharmazeutische Unternehmen müssen sicherstellen, dass der Zugriff auf elektronische Systeme und Daten auf autorisierte Personen beschränkt ist. Dies trägt zur Verhinderung von Datenmanipulation und -missbrauch bei.
- Datensicherung und Wiederherstellung: Der Annex 11 verlangt die Implementierung geeigneter Maßnahmen zur Datensicherung und -wiederherstellung. Dies stellt sicher, dass Daten im Falle eines Systemausfalls oder einer Datenbeschädigung nicht verloren gehen.
Ihr Weg in die Digitalisierung - Entdecken Sie unsere Software
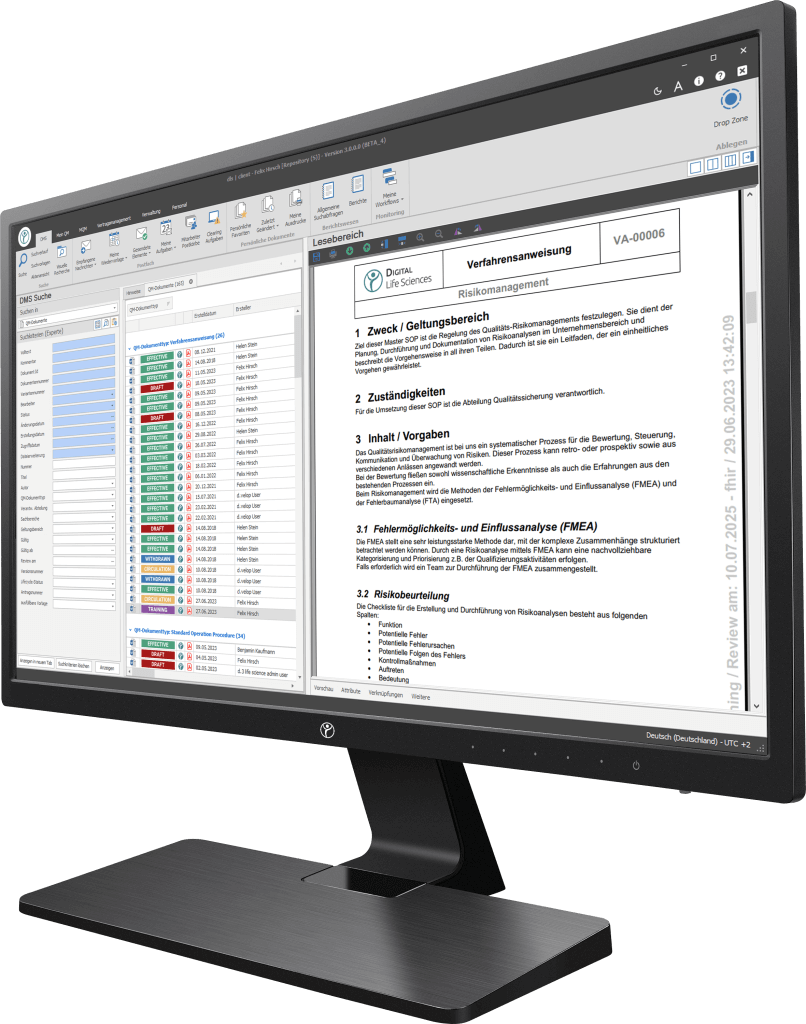
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
Herausforderungen bei der Umsetzung des EU-GMP-Leitfadens Annex 11
Die Umsetzung des Annex 11 stellt pharmazeutische Unternehmen vor erhebliche Herausforderungen. Sie erfordert umfangreiche Ressourcen und fundiertes Fachwissen. Die Einhaltung der Anforderungen ist jedoch essentiell, um die Qualität und Sicherheit von Medikamenten zu gewährleisten.
Überblick über andere wichtige Anhänge des EU-GMP-Leitfadens
EU-GMP-Leitfaden Annex 1
Der EU-GMP-Leitfaden Annex 1 ist entscheidend für die Herstellung steriler Arzneimittel. Er legt strenge Anforderungen an die Produktionsumgebung, Prozesse und Ausrüstung fest, um eine Kontamination der Produkte zu verhindern. Aufgrund seiner Bedeutung für die Produktsicherheit sind regelmäßige Reviews und Updates von Annex 1 zu erwarten.
EU-GMP-Leitfaden Annex 13
Der Annex 13 des EU-GMP-Leitfadens umfasst spezifische Richtlinien für die Herstellung und den Vertrieb von Prüfpräparaten. Diese müssen strenge Kriterien erfüllen, um sicherzustellen, dass klinische Studien zuverlässig und unter Einhaltung regulatorischer Vorgaben durchgeführt werden.
GMP-Leitfaden Annex 2
Im GMP-Leitfaden Annex 2 werden die Anforderungen für die Herstellung von Wirkstoffen beschrieben. Dieser Anhang ist für die Qualität und Reinheit der Ausgangsstoffe von großer Bedeutung und definiert genaue Verfahrensweisen zur Vermeidung von Kreuzkontamination und Verunreinigungen.
Fazit
Der EU-GMP-Leitfaden Annex 11 ist ein zentrales Dokument für die Pharmaindustrie. Es stellt sicher, dass computergestützte Systeme und elektronische Aufzeichnungen den höchsten Standards entsprechen. Die Einhaltung dieser Standards ist unerlässlich, um die Integrität von Daten und somit die Sicherheit von Medikamenten zu garantieren.
Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Was ist der Zweck des EU-GMP-Leitfadens Annex-11?
Der EU-GMP-Leitfaden Annex-11 legt die Anforderungen an computergestützte Systeme und elektronische Aufzeichnungen in der pharmazeutischen Industrie fest, um die Qualität und Sicherheit von Medikamenten zu gewährleisten.
Welche Unternehmen sind von den Anforderungen des Annex 11 betroffen?
Alle pharmazeutischen Unternehmen, die in der Europäischen Union tätig sind, müssen die Anforderungen des EU-GMP-Leitfadens Annex-11 erfüllen.
Warum ist die Validierung elektronischer Systeme so wichtig?
Die Validierung elektronischer Systeme gewährleistet, dass sie ordnungsgemäß funktionieren und zuverlässige Ergebnisse liefern, was entscheidend für die Qualität von Medikamenten ist.
Wie können pharmazeutische Unternehmen die Datensicherheit gemäß dem EU-GMP-Leitfaden Annex 11 gewährleisten?
Pharmazeutische Unternehmen müssen geeignete Maßnahmen zur Datensicherung und -wiederherstellung implementieren, um die Integrität von Daten zu schützen.
Welche Ressourcen werden für die Umsetzung des Annex-11 benötigt?
Die Umsetzung des EU-GMP-Leitfaden Annex-11 erfordert erhebliche Ressourcen, einschließlich Fachkenntnisse in der Validierung elektronischer Systeme und Datensicherheit.


