Definition des Begriffs („Was ist die Arzneimittel- und Wirkstoffherstellungsverordnung?“)
Die Arznei- und Wirkstoffherstellungsverordnung ist eine Verordnung über die Anwendung der guten Herstellungspraxis bei der Herstellung von Arzneimitteln und Wirkstoffen und über die Anwendung der fachlichen Praxis bei der Herstellung von Produkten menschlicher Herkunft. Sie wurde von den Bundesministerien für Gesundheit und Ernährung, Landwirtschaft und Verbraucherschutz im Einvernehmen mit den Bundesministieren für Wirtschaft, Technologie sowie Umwelt und mit Zustimmung des Bundesrates erlassen.
Warum ist Abschnitt 2, §10 der AMWHV wichtig?
Abschnitt 2, §10 ist ein spezifischer Teil der AMWHV, der sich mit der Qualitätssicherung von Arzneimitteln befasst. In ihm ist festgelegt, dass Betriebe und Einrichtungen ein Dokumentationssystem entsprechend der jeweils durchgeführten Tätigkeiten unterhalten müssen. Die Dokumentation hat klar und fehlerfrei zu erfolgen und auf dem neuesten Stand zu sein. Werden Aufzeichnungen mit elektronischen Datenverarbeitungssystemen gemacht, ist das System ausreichend zu validieren. Die Sicherstellung, dass die Daten während der Aufbewahrungsfrist verfügbar sind und innerhalb einer angemessenen Frist lesbar gemacht werden können, ist eine Grundvoraussetzung. Die Daten müssen während der Dauer der Aufbewahrungsfrist gegen Verlust und Beschädigung geschützt sein. Die Ordnung der Aufzeichnungen hat so zu erfolgen, dass der unverzügliche Rückruf eines Produktes ermöglicht werden kann. In Bezug auf Software hat der Anbieter somit zu gewährleisten, dass diese jederzeit zur Verfügung steht und die Dokumentation stets zugänglich ist.
Welche Anforderungen gibt es an die Qualitätssicherung?
Unter Abschnitt 2, §10 der AMWHV sind die Hersteller verpflichtet, ein umfassendes Qualitätsmanagementsystem einzurichten. Dies umfasst die Überwachung und Kontrolle aller Herstellungsprozesse sowie die Dokumentation von Verfahren und Ergebnissen.
Warum sind Inspektionen und Audits wichtig?
Eine wichtige Komponente von §10 sind die regelmäßigen Inspektionen und Audits, die von den zuständigen Behörden durchgeführt werden. Diese sollen sicherstellen, dass die Hersteller die Anforderungen der Verordnung kontinuierlich erfüllen.
Ihr Weg in die Digitalisierung - Entdecken Sie unsere Software
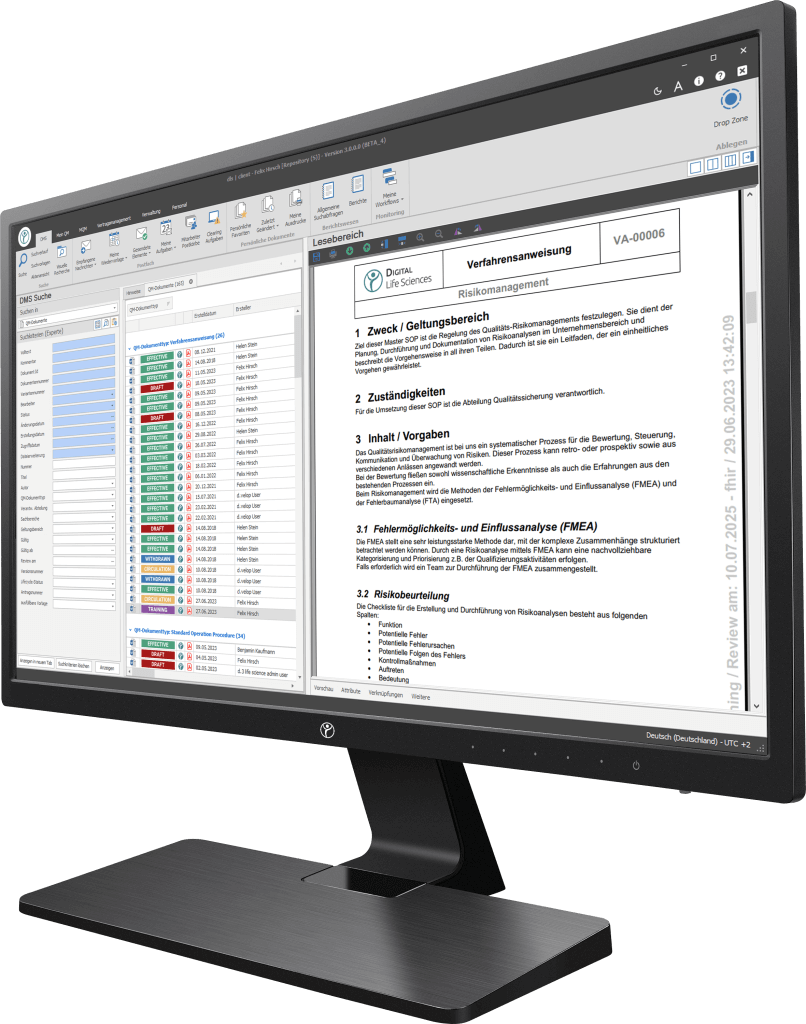
Unsere Digitalisierungslösungen adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung, Produktion und des Qualitätsmanagements. Die Basis des dls | eQMS bildet ein ganzheitliches ECM/DMS-System. Das ECM/DMS-System kann an Ihr bestehendes ERP-System (z. B. SAP) angebunden werden und somit nahezu sämtliche dokumentenbasierte Prozesse im Unternehmen abbilden.
Die Bedeutung der Compliance
Die Einhaltung von Abschnitt 2, §10 der AMWHV ist für Hersteller von Arzneimitteln von entscheidender Bedeutung. Die Nichteinhaltung dieser Vorschriften kann schwerwiegende rechtliche Konsequenzen haben.
- Risiken bei Nichteinhaltung: Wenn Hersteller die Anforderungen von §10 nicht erfüllen, können ihre Produkte als unsicher oder unwirksam eingestuft werden. Dies kann zu Rückrufen, Haftungsansprüchen und Reputationsschäden führen.
- Vorteile der Compliance: Die strikte Einhaltung von §10 kann dagegen dazu beitragen, die Qualität und Sicherheit von Arzneimitteln zu gewährleisten. Dies stärkt das Vertrauen der Verbraucher und fördert den Erfolg der Hersteller.
Herausforderungen und Entwicklungen bei Abschnitt 2, §10 der AMWHV
Abschnitt 2, §10 der AMWHV ist nicht in Stein gemeißelt und unterliegt Veränderungen und Aktualisierungen, um den sich wandelnden Anforderungen gerecht zu werden.
- Aktuelle Entwicklungen: In den letzten Jahren gab es einige wichtige Entwicklungen in Bezug auf §10, darunter die Einführung neuer Technologien zur Qualitätssicherung und die Harmonisierung mit internationalen Standards.
- Zukunftsausblick: Die Zukunft von Abschnitt 2, §10 wird sich wahrscheinlich weiterentwickeln, um den Fortschritt in der Arzneimittelherstellung zu reflektieren. Dies erfordert eine kontinuierliche Anpassung und Schulung der Hersteller.
Was fordert daraufhin §20 der AMWHV?
Der § 20 „Aufbewahrung der Dokumentation“ fordert, dass die Aufbewahrung sämtlicher Dokumente ausschließlich in von der AMWHV geeigneten und erlaubten Räumen erfolgen kann. Der Raum hat in der Regel auf dem eigenen Betriebsgelände zu sein. Die AMWHV verweist zur näheren Konkretisierung der in ihr enthaltenen Anforderungen auf den EU-GMP Leitfaden.
Fazit
Die Arzneimittel- und Wirkstoffherstellungsverordnung, insbesondere Abschnitt 2, §10, spielt eine zentrale Rolle in der Qualitätssicherung von Arzneimitteln in Deutschland. Die Einhaltung dieser Vorschriften ist von größter Bedeutung, um die Sicherheit und Wirksamkeit von Arzneimitteln zu gewährleisten.
Starten Sie Ihre digitale Transformation mit unseren leistungsstarken, modularen Softwarelösungen
Häufig gestellte Fragen (FAQs)
Welche Unternehmen müssen Abschnitt 2, §10 der AMWHV beachten?
Alle Unternehmen, die Arzneimittel oder Wirkstoffe herstellen, müssen die Vorschriften von §10 der AMWHV beachten.
Gibt es Sanktionen für die Nichteinhaltung von §10?
Ja, bei Nichteinhaltung von §10 der AMWHV können rechtliche Sanktionen wie Geldstrafen und Produkt-Rückrufe verhängt werden.
Wie können Hersteller sicherstellen, dass sie §10 der AMWHV einhalten?
Hersteller können die Einhaltung von §10 sicherstellen, indem sie ein umfassendes Qualitätsmanagementsystem implementieren und regelmäßige Inspektionen und Audits durchführen.
Welche Rolle spielen Inspektionen und Audits in Bezug auf §10?
Inspektionen und Audits sind entscheidend, um sicherzustellen, dass Hersteller die Anforderungen von §10 erfüllen und die Qualität ihrer Produkte aufrechterhalten.
Wo finde ich weitere Informationen zu §10 der AMWHV?
Weitere Informationen zu §10 der AMWHV und anderen relevanten Vorschriften finden Sie auf der Website der zuständigen Gesundheitsbehörde.


