Digitale und GxP-konforme technische Dokumentation für Medizinprodukte

Amann Girrbach
Das deutsch-österreichische Unternehmen Amann Girrbach vertreibt Medizinprodukte in der ganzen Welt. So unterschiedlich die Kulturen sind, eines eint die Nationen: Medizinprodukte müssen einwandfrei sein. Deshalb muss Amann Girrbach nicht nur die exzellente Qualität seiner Produkte und Dienstleistungen sicherstellen, das Unternehmen muss auch die zurecht hohen Ansprüche der jeweiligen regulatorischen Behörden erfüllen. Und die Anforderungen steigen seit Jahren.
Mit weltweit über 430 Mitarbeitern stellt Amann Girrbach rund 10 Produktgruppen her und muss daher Hunderte von Arbeitsschritten, Rezepturen, Mischungsverhältnisse, Prozesse, Abläufe und Maßnahmen zur Qualitätssicherung dokumentieren. Und das für unterschiedliche Behörden in verschiedenen Ländern. Die technische Dokumentation muss auch die Richtlinien für gute Arbeitspraxis erfüllen, die unter dem Stichwort „GxP“ bekannt sind.
In Deutschland prüfen beispielsweise der TÜV Süd die Medizinprodukte, die Dekra oder auch der TÜV Nord. In den USA überwacht die Food and Drug Administration (FDA) die Qualität von Lebens- und Arzneimitteln, in anderen Ländern gibt es vergleichbare Behörden. Andere Länder, andere Formulare, andere Anforderungen – und ein hoher Aufwand für Amann Girrbach, viele unterschiedliche Medizinprodukte weltweit anbieten zu können. Zumal die technische Dokumentation in der Vergangenheit noch auf Papier erfolgte.

Technische Dokumentation für Medizinprodukte aktuell halten
„Wir arbeiten an zwei Standorten“, beschreibt Philipp Wildgrube, Regulatory Affairs Manager bei Amann Girrbach, „in Koblach in Österreich und in Pforzheim. Mit der Zeit wurde es immer anspruchsvoller, die technische Dokumentation aktuell zu halten.“ Zudem: „Auf dem Postweg brauchten die Dokumente mitunter lange, um von einem Standort zum nächsten zu gelangen.“
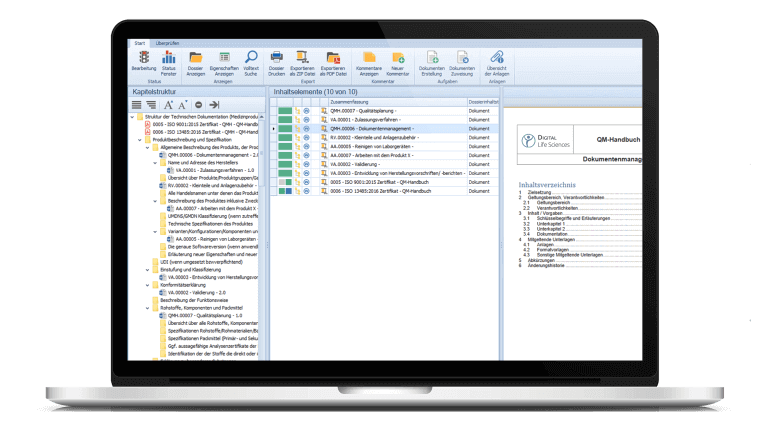
Also suchte Amann Girrbach nach einem Partner zur digitalen Abbildung ihrer technischen Dokumentationen. Das System musste flexibel und vom Anwender individuell konfigurierbar sein. Gleichzeitig sollte ein Software-Anbieter über umfassendes Know-how im GxP-Bereich verfügen.
Auf der Industrie-Messe Control in Stuttgart wurde Amann Girrbach auf das Dokumentenmanagementsystem d.velop documents (ehemals d.3ecm) der d.velop AG aufmerksam. Damit können Unternehmen Informationen und Prozesse schnell und effektiv digitalisieren. Das Dokumentenmanagement kann zum zentralen Speicherort für sämtliche Informationen und Dokumente eines Unternehmens werden, und mit den branchenspezifischen und GxP-konformen zusätzlichen Modulen und Dienstleistungen der Digital Life Sciences gelingt die Anpassung an die individuellen Anforderungen von Amann Girrbach.
GxP-konforme Dokumentationslösung
Die Digital Life Sciences GmbH ist das Kompetenzzentrum der d.velop AG für GxP-konforme Dokumentenlösungen und für elektronische Qualitätsmanagementlösungen. Mit rund 60 Mitarbeitern betreut die Digital Life Sciences rund 130 Kunden, die meisten davon sind im validierten GxP-Umfeld tätig – zum Beispiel in der Medizintechnik oder in der Pharma-Branche.
Gerade Unternehmen im medizinischen Bereich müssen sich mehr und mehr Gedanken über die technische Dokumentation ihrer Produkte machen, seit Jahren wachsen hier die regulatorischen Anforderungen der Gesetzgeber und Prüfstellen. Da hilft das Dokumentenmanagementsystem, den Überblick und die Kontrolle zu behalten. Das hat Amann Girrbach sich schnell zu Nutze gemacht.
Flexible ECM-Lösung für Pharmabranche
„Für die Lösung von d.velop sprach vor allem die Flexibilität“, beschreibt Philipp Wildgrube. „Wir konnten das Dokumentenmanagementsystem von Anfang an nach unseren Vorstellungen individuell konfigurieren lassen, so dass es zu 100 Prozent zu unseren Anforderungen gepasst hat. Andere Anbieter konnten das so nicht liefern.“ Zu den Anforderungen gehörte zum Beispiel, die Struktur der technischen Dokumentation von Amann Girrbach abbilden zu können.
Im Jahr 2015 starteten Amann Girrbach und die Digital Life Sciences das gemeinsame Projekt und begannen, das Dokumentenmanagement zu installieren, Prozesse zu optimieren und Informationen zu digitalisieren. Erste Erfolge waren schnell zu sehen, und da sich die gesetzlichen Rahmenbedingungen laufend ändern, kommt es immer wieder zu Anpassungsarbeiten. Eine Triebfeder war unter anderem die neue europäische Medizinprodukte-Verordnung (Medical Device Regulation, MDR) aus dem Jahr 2017.
Technische Dokumentation 2.0
Die Anforderungen, die die Regulierungsbehörden an die Medizinunternehmen stellen, sind vielfältig und zum Teil erheblich. Dazu gehören zum Beispiel Originaldokumente, die nach der Freigabe nicht mehr verändert werden dürfen. „Das kann unsere Softwarelösung abbilden“, sagt Frank Laumann, Head of Service und Prokurist bei der Digital Life Sciences. Mit dem Einsatz des Digital Life Sciences Clients kann Amann Girrbach nun sicher GxP-Prozesse abbilden.
Zu den Vorteilen der Software gehören zum Beispiel:
- Vollständige digitale Verwaltung des Dossiers
- Digitale Erstellung und Aktualisierung der Technischen Dokumentation im Rahmen der Anforderungen der Medical Device Regulation
- Verabschiedung von unaufgeräumten Fileservern mit Mehrfachablagen und redundanten Ordnerstrukturen
- Minimierung der Prozesslaufzeiten für die Erstellung, Überarbeitung und Freigabe von Dossiers
- Versionierung des Dossiers
- Export des gesamten Dossiers
- Vollständigkeitsprüfung des Dossiers
„Die Informationen sind nun vernünftig und logisch strukturiert“, sagt Philipp Wildgrube, „das war schön und einfach mit und von d.velop. Mit der Software kann man so gut wie alles abbilden, was man möchte.“ Einer der stärksten Vorteile des GxP-konformen, digitalen Dokumentenmanagementsystems sind die schnellen Zugriffszeiten. Kein Mitarbeiter muss mehr Papierstapel durchblättern oder die Postablage durchsuchen. Laumann: „Die Informationen sind viel schneller auffindbar, alle Mitarbeiter, die Zugriff brauchen, haben einen zentralen Zugang.“
Support Team und Ansprechpartner
Ein schneller Zugriff auf Informationen gehört für Amann Girrbach zu den wichtigsten Anforderungen an ein GxP-konformes Dokumentenmanagementsystem. „Der große Vorteil ist bei dem d.velop-Produkt, dass wir schnell und ohne große Mühen auf Dokumente zugreifen können“, beschreibt Wildgrube. Und: „Wir sind mit der Arbeitsweise des Systems und auch des Support Teams sehr zufrieden.“
Projektpartner
Seit 2007 ist die Digital Life Sciences GmbH das Competence Center der d.velop AG für GxP-konforme Dokumentationslösungen. Thilo Gukelberger, einer der beiden Gründer der d.velop AG, führt das Unternehmen zusammen mit weiteren langjährigen Mitarbeitern der AG. Sie sind auch wesentliche Miterfinder des Basis-Produktes d.velop documents (ehemals d.3ecm), welches mittlerweile bei mehr als 12.500 Kunden weltweit als zentrales ECM-/DMS-/Archivsystem eingesetzt wird. Die Lösungen der Digital Life Sciences GmbH verstehen sich als komplementäre Ergänzung zu d.velop documents (ehemals d.3ecm). Sie adressieren in erster Linie dokumentenbasierte Prozesse der Herstellung/Produktion und des Qualitätsmanagements. Neben Kunden aus der klassischen Life Sciences Industrie (Pharma, Medizintechnik, Nahrungsergänzungsmittel, Kosmetik) vertrauen auch Unternehmen aus der Stahlindustrie und der Dienstleistungsbranche den Lösungen der Digital Life Sciences GmbH.
Erfahren Sie mehr über die Technische Dokumentation