ISPE GAMP®5, 2nd Edition in der Praxis: Systemkategorisierung & Risikomanagement computergestützter Systemvalidierung
In der Pharmaindustrie ist die Validierung computergestützter Systeme essenziell, um die hohen Anforderungen an Qualität, Sicherheit und Compliance zu gewährleisten. Fehlerhafte Systeme können gravierende Folgen nach sich ziehen, angefangen bei Produktmängeln bis hin zu regulatorischen Verstößen. Unternehmen stehen daher vor der Herausforderung, ihre Systeme nicht nur regelkonform, sondern auch effizient und risikobasiert zu validieren.
Der ISPE GAMP®5, 2nd Edition bietet Unternehmen einen praxisorientierten Rahmen für die risikobasierte Validierung und Kategorisierung computergestützter Systeme. Ziel der Leitlinie ist es, sicherzustellen, dass IT-Systeme die hohen Anforderungen an Produktqualität, Patientensicherheit, Datenintegrität und Compliance erfüllen.
In diesem Beitrag werden zwei zentrale Elemente der computergestützten Validierung beleuchtet: die Systemkategorisierung gemäß ISPE GAMP®5, 2nd Edition und die Implementierung des Risikomanagements.
Warum sind Systemkategorisierung und Risikomanagement die Basis jeder effizienten Validierungsstrategie?
Die Validierung computergestützter Systeme ist obligatorisch – unabhängig davon, ob es sich dabei um eine einfache Excel-Tabelle oder ein komplexes Produktionssteuerungssystem handelt. Je nach Art, Komplexität und GxP-Relevanz variieren die Anforderungen.
Systemkategorisierung und Risikomanagement als integratives Validierungskonzept
Die Systemkategorisierung dient dazu, Systeme nach ihrer Komplexität und dem Grad ihrer Individualisierung einzuordnen. In diesem Kontext gibt es zwei Ansätze zur Kategorisierung von Validierungsobjekten (Systeme, Applikationen):
- Gesamtbewertung des Systems: Das System wird basierend auf der höchsten Kategorisierung der kritischsten Einzelkomponente validiert und bestimmt somit die Gesamtbewertung.
- Einzelbewertung der Systemkomponenten: Jede Komponente des Systems wird separat validiert und kategorisiert. Dadurch lassen sich gezielte und passgenaue Validierungsmaßnahmen für einzelne Komponenten definieren.
Das Risikomanagement identifiziert, bewertet und steuert Risiken, die potenzielle Auswirkungen auf die Produktqualität, die Patientensicherheit, die Datenintegrität und die Compliance haben können.
Durch die enge Verknüpfung von Systemkategorisierung und Risikomanagement entsteht ein risikobasiertes Validierungskonzept, das den Anforderungen der EU-GMP-Leitlinie, Anhang 11, und des ICH Q9, „Quality Risk Management“, gerecht wird.
Systemkategorisierung gemäß ISPE GAMP®5, 2nd Edition – Das Fundament für eine erfolgreiche Validierung
ISPE GAMP®5, 2nd Edition: Praxisleitfaden für Systemkategorisierung
Die Systemkategorisierung stellt einen bedeutenden ersten Schritt bei der Validierung computergestützter Systeme dar. Bereits in der Planungsphase kann der Validierungsaufwand frühzeitig besser abgeschätzt und eingeordnet werden. Die Kategorisierung unterstützt dabei die gezielte Einteilung der Systeme in verschiedene Kategorien je nach Art (Standard, konfigurierbar, kundenspezifisch) und Komplexität. Sie bildet damit die Grundlage für maßgeschneiderte und skalierbare Validierungsmodelle, wie z. B. das V-Modell.
Die Systemkategorisierung gemäß ISPE GAMP®5, 2nd Edition dient als praxisorientierter Leitfaden und sollte nicht als starre Vorgabe verstanden werden. Die eingesetzten Systeme werden dabei in vier Softwarekategorien (1, 3-5) eingeteilt:
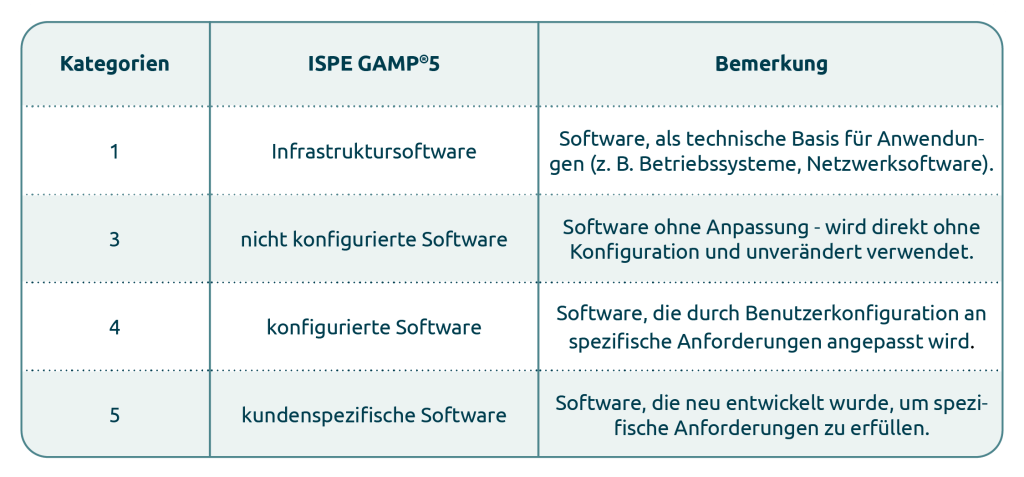
Softwarekategorien – Systeme optimal einordnen
Darüber hinaus wird empfohlen, die Systeme in weitere nutzenspezifische Gruppen zu unterteilen. So können Systemtypen mit ähnlichen potenziellen Risiken und Anforderungen einheitlich bewertet und validiert werden:
- Prozessanlagen
- Laborsysteme
- Tabellenkalkulationsprogramme (z. B. Excel)
Weitere Kriterien, die relevant sein könnten:
- Einzelplatzlösung, Netzwerkbetrieb
- Server-/Client-Strukturen
- Cloud-basierte Systeme
Bedeutung der Kategorisierung – Effizienzsteigerung durch präzise Zuordnung und Risikobewertung
Die Kategorisierung (Kategorie 1, 3-5) dient als erste Orientierung zur Einschätzung des Validierungsaufwandes. In der Praxis treten jedoch häufig Mischformen auf, beispielsweise eine Kombination aus Kategorie 3 und 4. Eine präzise Zuordnung der Anforderungen zu den jeweiligen Kategorien ist daher von entscheidender Bedeutung.
Die Kategorisierung gemäß ISPE GAMP®5, 2nd Edition bildet die Grundlage für die Durchführung von Risikomanagement-Maßnahmen, um eine praxisnahe, effiziente und skalierbare Validierungsplanung zu gewährleisten. Zusätzliche Kriterien wie z. B. die GxP-Relevanz und die damit verbundene Auswirkung auf Patientensicherheit, Produktqualität und Datenintegrität sind ebenfalls zu bewerten.
Qualitätsrisikomanagement: Schlüssel für eine sichere und konforme Systemvalidierung
Risikomanagement: Prozess zur Risikoidentifikation und -steuerung
Das Qualitätsrisikomanagement stellt einen systematischen Prozess dar, dessen Ziel die Beurteilung, Steuerung, Kommunikation sowie Überwachung von Risiken über den gesamten Lebenszyklus eines Systems ist. Das Risikomanagement umfasst verschiedene Phasen, darunter die Risikobeurteilung (bestehend aus Risikoidentifikation, Risikoanalyse und Risikobewertung), die Risikosteuerung (einschließlich Risikoakzeptanz und Risikominderung) sowie die Risikokommunikation und die Risikoüberwachung.
Risikobeurteilung: Der erste Schritt zur Risikominderung
Gemäß ISPE GAMP®5, 2nd Edition erfolgt die Risikoanalyse bereits im Rahmen der Lastenhefterstellung.
Gemäß der ISPE GAMP®5, 2nd Edition ist eine Prozessrisikoanalyse durchzuführen, um Risiken hinsichtlich Patientensicherheit, Produktqualität, Datenintegrität und Compliance zu identifizieren. Das Ziel besteht darin, das Risikopotenzial einer Anforderung zu bewerten und zu bestimmen, ob zusätzliche Maßnahmen zur Risikominimierung erforderlich sind.
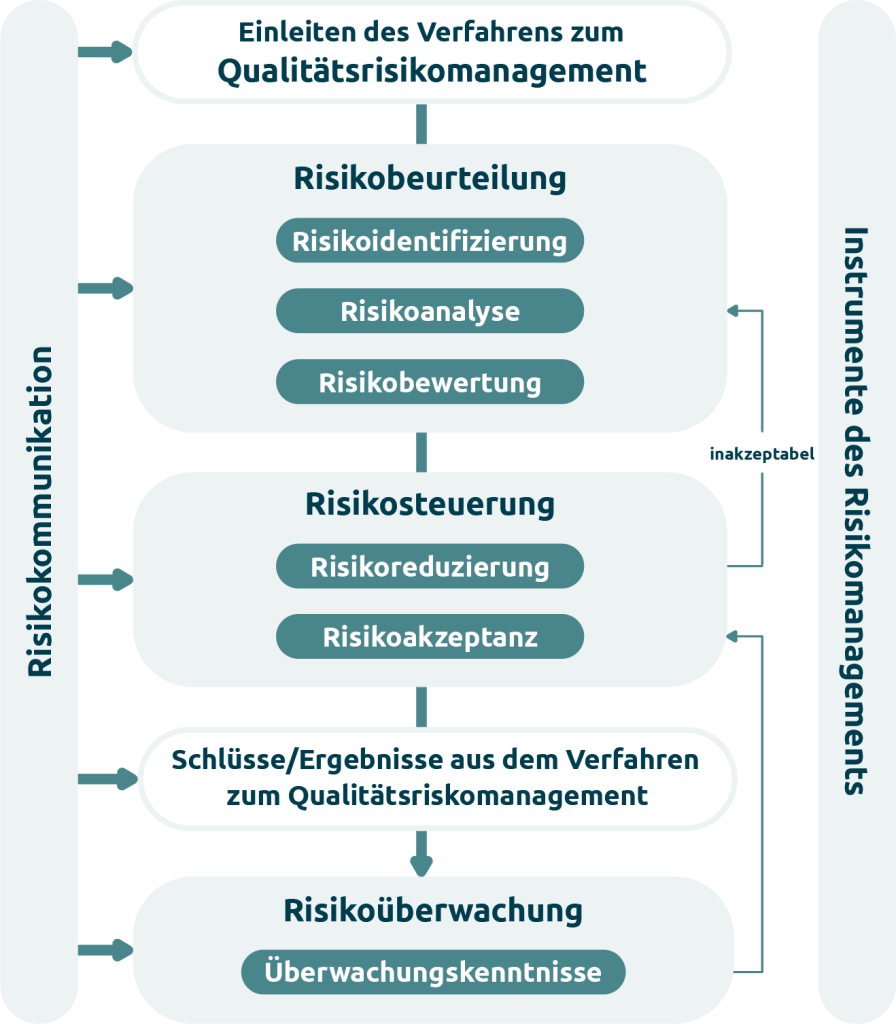
- Risikoidentifikation: Zu Beginn werden potenzielle Risiken in Bezug auf Funktionen, Schnittstellen, implementierte Anforderungen, Benutzerinteraktionen und technische Komponenten identifiziert, um sowohl Anwender als auch den Gesamtprozess proaktiv vor Anwendungs- und Umsetzungsfehlern bei Anforderungen zu schützen.
- Risikoanalyse: Jedes identifizierte Risiko wird anhand seiner Eintrittswahrscheinlichkeit und potenziellen Auswirkung bewertet. Im weiteren Verlauf des Prozesses werden die Risiken priorisiert und bilden damit den Grundbaustein für eine gezielte Einteilung.
- Risikobewertung: Das Resultat der Risikoanalyse wird üblicherweise in Form einer Risikoprioritätszahl zusammengefasst.
- Risikoklassifizierung: Die Risikoklassifizierung stellt sicher, dass der Aufwand und die Maßnahmen im Verhältnis zur tatsächlichen Auswirkung eines Systems auf GxP-relevante Aspekte stehen. Dazu wird die Risikoprioritätszahl in Stufen (hoch, mittel, niedrig) unterteilt.
- Dokumentation: Alle relevanten Schritte, Bewertungen und Maßnahmen müssen vollständig nachvollziehbar und GxP-konform gemäß Annex 11 und EU-GMP-Leitfaden Teil I, Kapitel 4 dokumentiert werden.
Ein fundiertes Risikomanagement bildet somit die Grundlage für eine zielgerichtete, wirtschaftliche und GxP-konforme Validierungsstrategie.
Detaillierte Anforderungen an computergestützte Systeme gemäß der AMWHV können Sie im folgenden Leitartikel nachlesen: GMP LOGFILE: Leitartikel – GMP-Verlag: Anforderungen der AMWHV für computergestützte Systeme
Wenn Sie weitere Informationen zur Einordnung unserer Lösungen in die verschiedenen Kategorien wünschen, können Sie diese gerne bei uns anfordern.
Risikosteuerung: Effektive Maßnahmen zur Risikominimierung
Auf Grundlage der identifizierten und klassifizierten Risiken werden mitigierende Maßnahmen festgelegt. Dazu zählen u. a. Testfälle, mit denen sichergestellt wird, dass die risikoreichsten und kritischsten Systemfunktionen angemessen getestet werden. Dabei ist zu berücksichtigen, dass eine vollständige Prüfung aller Systemfunktionen in der Praxis nicht durchführbar ist und einzelne Tests keinen Nachweis über die Vollständigkeit der Software liefern können. Die Risikosteuerung dient dazu, identifizierte Risiken durch geeignete Maßnahmen zu minimieren, zu kontrollieren oder auf ein akzeptables Niveau zu senken.
Ein Risiko gilt erst dann als gesteuert, wenn sein Niveau nachweislich reduziert wurde. Im Sinne der ICH Q9 wird die Verlagerung auf andere Bereiche oder Prozesse nicht als Risikominimierung angesehen.
Strategien zur Risikosteuerung und -kontrolle (nach ISPE GAMP®5 Anhang M3)
Risikominderung – Prozess- und Systemdesign-Anpassungen:
- Automatisierte Datenprüfungen (z. B. Plausibilitäts- und Verifikationschecks)
- Elektronische Sicherungen zur Vermeidung von Doppelkontrollen
- Schulung der Endanwender: GxP-Risiken und Systemgebrauch
- Prüfung alternativer technischer Lösungen bei erhöhten Anforderungen
Risikominderung – Strategie verändern:
- Schulungen zur Risikoerkennung und -kommunikation
- Strukturierte Kontrolle des Fortschritts zur besseren Kontrolle risikoreicher Projekte
Risikoeliminierung:
- Organisatorische oder technische Maßnahmen zur Risikoeliminierung
- Anforderungen mit zu hohem, nicht minderbarem Risiko sollten nicht umgesetzt werden
Risikoakzeptanz:
- Akzeptanz eines Restrisikos, wenn weitere Minimierung unverhältnismäßig zum Risiko ist
- Kann aktiv (formelle Entscheidung) oder passiv (passive Entscheidung) erfolgen
Risikokommunikation: Transparenz schaffen – Risiken managen
Die Risikokommunikation ist ein kontinuierlicher Austausch über Risiken und Risikomanagement zwischen allen Beteiligten. Sie erfolgt über den gesamten Validierungsprozess hinweg und sollte dauerhaft gepflegt werden.
Die Traceability Matrix ist ein bewährtes Instrument zur strukturierten Risikokommunikation. Dieses Tool dokumentiert Anforderungen, funktionale Spezifikationen und identifizierte Risiken. Dadurch wird sichergestellt, dass potenzielle Schwachstellen und kritische Aspekte transparent und nachvollziehbar bleiben.
Darüber hinaus ist es empfehlenswert, dokumentierte Risiken aus vergleichbaren, bereits validierten Systemen heranzuziehen. Um die Risiken weiter zu reduzieren, sollten wertvolle Erkenntnisse aus früheren Validierungsprojekten in die aktuelle Validierung einfließen. Dazu zählen bereits bewertete Risiken sowie implementierte Kontroll- und Überwachungsmaßnahmen.
Risikoüberwachung: Risiken im Blick – Sicherheit im gesamten Systemlebenszyklus
Die Risikoüberwachung bezeichnet die kontinuierliche Beobachtung und Bewertung potenzieller Risiken über den gesamten Lebenszyklus. Der Prozess wird von der Initiierung bis zum Abschluss begleitet, um bestehende Risiken frühzeitig zu erkennen und die Wirksamkeit der getroffenen Maßnahmen zu bewerten. Darüber hinaus ermöglicht dies die Identifikation neuer potenzieller Risiken für das Unternehmen, um gezielte Gegenmaßnahmen abzuleiten. Die konsequente Überwachung des Systems gewährleistet, dass es dauerhaft den hohen Anforderungen an Qualität, Sicherheit und Compliance entspricht.
Systemkategorisierung und Risikomanagement – zwei zentrale Erfolgsfaktoren risikobasierter Validierung
Das Zusammenspiel von Systemkategorisierung und risikobasiertem Qualitätsmanagement ist essenziell für eine erfolgreiche Validierung. Die Kategorisierung gemäß ISPE GAMP®5, 2nd Edition ermöglicht eine optimale Einschätzung des Validierungsaufwands und bildet die Grundlage für einen skalierbaren Validierungsansatz.
Das Risikomanagement stellt über den gesamten Lebenszyklus eines Systems sicher, dass potenzielle Risiken für Patientensicherheit, Produktqualität, Datenintegrität und Compliance frühzeitig erkannt, bewertet und wirksam minimiert werden.
Eine ausgewogene Risikoakzeptanz ist entscheidend.
Ein Restrisiko wird nur dann akzeptiert, sofern die weitere Minimierung einen unverhältnismäßig hohen Aufwand erfordert.
Die Risikokommunikation kann durch die Nutzung der Traceability Matrix unterstützt werden. Sie fördert den Austausch, dokumentiert Risiken transparent und bezieht Erkenntnisse aus früheren Validierungsprojekten mit ein. Die Risikoüberwachung identifiziert frühzeitig potenzielle Risiken und leitet rechtzeitig gezielte Maßnahmen ein. Das System erfüllt dauerhaft die hohen Anforderungen an Qualität, Sicherheit und Compliance.
Insgesamt schafft die Kombination aus Systemkategorisierung und Risikomanagement eine valide, flexible und GxP-konforme Validierungspraxis, die maßgeschneidert auf die Komplexität und Relevanz des jeweiligen Systems abgestimmt ist.




